Химия - Именные реакции в органической химии - Реакция Бородина — Хунсдикера
01 марта 2011Оглавление:
1. Именные реакции в органической химии
2. Реакция Аллана — Робинсона
3. Реакция Ауверса
4. Реакция Барджеллини
5. Реакция Бородина — Хунсдикера
6. Реакция Бутлерова
7. Реакции Ганча
8. Реакция Зандмейера
9. Реакция Кижнера — Вольфа
10. Реакция Кольбе — Шмидта
11. Реакция Кучерова
12. Реакция Мицунобу
13. Реакция Стилла
14. Реакция Фаворского — Реппе
15. Реакция Хека
англ. Hunsdiecker reaction или англ. Borodin-Hunsdiecker reaction
Реакция серебряных солей карбоновых кислот с галогенами, дающая в результате галогенозамещенные углеводороды.
Реакция Бриггса — Раушера
англ. Briggs-Rauscher reaction или англ. Briggs-Rauscher oscillating reaction
Автоколебательная химическая реакция. При взаимодействии пероксида водорода, йодноватой кислоты, сульфата марганца, серной и малоновой кислот и крахмала возникает колебательная реакция с переходами бесцветный — золотой — синий.
Перегруппировка Брука
англ. Brook rearrangement
Изомеризация α-, β- и γ-силилсодержащих спиртов в силильные эфиры под действием основания.
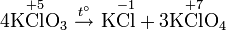
Реакция Буво — Блана
англ. Bouveault-Blanc reduction
Образование α-гидроксикетонов при восстановлении сложных эфиров моно- и дикарбоновых алифатических кислот натрием в инертной атмосфере. Впервые реакцию наблюдали в 1903 г. Л. Буво и Г. Блан.
Включает несколько стадий:
- Образование анион-радикала
- Образование аниона.
Конечным продуктом реакции является 1,2-кетон—ендиолят, который после протонирования превращается в α-оксикетон

Однако эта реакция не нашла применения в органической химии до тех пор, пока А. Штоль и В. Прелог в 1947 г. не применили ее для синтеза карбоциклических соединений со средним или большим размером цикла из диэфиров α,ω-дикарбоновой кислоты. Реакцию проводили в кипящем ксилоле при перемешивании с мелкодиспергированным натрием в токе аргона-для предотвращения окисления натрия и промежуточных анионов. В этом случае конденсация дает прекрасный выход.
Для повышения выхода реакции используют триметилхлорсилан, образующиеся при этом бис-триметилсилиловые эфиры ендиолов легко выделяются и при взаимодействии со спиртом образуют ацилоины. Это позволяет не только повысить выход, но и свести к минимуму побочные процессы

Такая методика ацилоиновой конденсации стала общепринятой.
Просмотров: 23932
|
|