Химия - Индольные алкалоиды - Биосинтез
28 февраля 2011Оглавление:
1. Индольные алкалоиды
2. Классификация
3. Изопреноидные индольные алкалоиды
4. Бисиндольные алкалоиды
5. Биосинтез
6. Физиологическая активность
7. Применение
Биогенетическим предшественником всех индольных алкалоидов является аминокислота триптофан. Для большинства из них первым шагом является декарбоксилирование триптофана с образованием триптамина. Диметилтриптамин образуется из триптамина посредством метилирования при участии кофермента S-аденозилметионина. Псилоцин образуется из диметилтриптамина посредством окисления и в дальнейшем фосфорилируется до псилоцибина.
При биосинтезе серотонина промежуточным соединением является не триптамин, а 5-гидрокситриптофан, который уже в свою очередь декарбоксилируется с образованием 5-гидрокситриптамина.
Биосинтез β-карболиновых алкалоидов происходит посредством образования основания Шиффа из триптамина и альдегида и последующей внутримолекулярной реакции Манниха, где атом углерода C2 индольного ядра выступает в роли нуклеофила. После этого ароматичность восстанавливается с потерей протона при атоме углерода C2. Получившийся тетрагидро-β-карболиновый скелет затем последовательно окисляется до дигидро-β-карболинового и β-карболинового. При образовании простых β-карболиновых алкалоидов, таких как гармин и гармалин роль кетокислоты выполняет пировиноградная кислота. При синтезе монотерпеноидных индольных алкалоидов в качестве альдегида участвует секологанин. Пирролоиндольные алкалоиды синтезируются в живых организмах аналогичным способом.
Биосинтез алкалоидов спорыньи начинается с алкилирования триптофана диметилаллилпирофосфатом, при этом атом углерода C4 индольного ядра играет роль нуклеофила. Образовавшийся 4-диметилаллил-L-триптофан подвергается N-метилированию. Дальнейшими ступенями биосинтеза являются ханоклавин-I и агроклавин. Последний гидроксилируется до элимоклавина, который в свою очередь окисляется до паспаловой кислоты. В процессе аллильной перегруппировки паспаловая кислота преобразуется в лизергиновую кислоту.

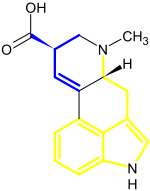
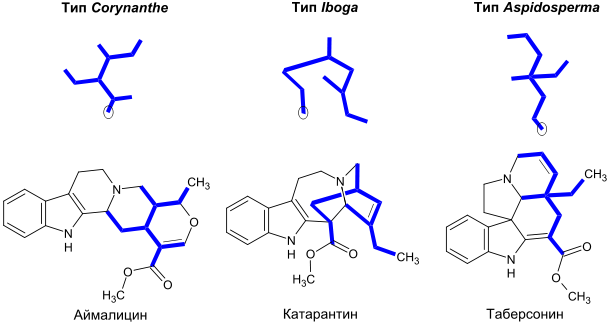
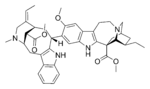
Биосинтез монотерпеноидных индольных алкалоидов начинается реакцией Манниха с участием триптамина и секологанина, в результате которой образуется стриктозидин, преобразуемый в дальнейшем в 4,21-дегидрогейсошизин. Далее биосинтез большинства алкалоидов с неперегруппированной монотерпеноидной частью продолжается посредством циклизации с образованием катенамина и последующего восстановления до аймалицина в присутствии никотинамидадениндинуклеотидфосфата. При биосинтезе других алкалоидов 4,21-дегидрогейсошизин сначала преобразуется в преакуамицин, алкалоид подтипа Strychnos типа Corynanthe, из которого в свою очередь образуются другие алкалоиды подтипа Strychnos, а также алкалоиды типов Iboga и Aspidosperma. Бисиндольные алкалоиды винбластин и винкристин получаются в процессе реакции, вовлекающей катарантин и виндолин.

Просмотров: 8278
|
|