Химия - Иодная кислота
01 марта 2011Оглавление:
1. Иодная кислота
2. Применение
Свойства
Иодная кислота хорошо растворима в воде. В водном растворе Н5IO6 – слабая кислота.
В растворах существует ряд гидратов состава mHIO4•nН2О, которые можно рассматривать как представителей ряда многоосновных кислот H3IO5, H4I2O9, H5IO6 и т. д. Их устойчивость зависит от концентрации раствора. Ион имеет октаэдрическую структуру.
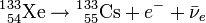
Кислотные свойства НIO4 выражены несравненно слабее, чем у HClO4, в то время, как она проявляет более сильные окислительные свойства = 1,64 В.). Отвечающий ей ангидрид неизвестен. При нагревании НIO4разлагается по уравнению:
- НIO4 → Н2О + I2O5 + О2
Периодаты
В зависимости от условий реакции иодная кислота образует ряд солей, содержащих ионы, IO6, IO5, IOи I2O9 – соответственно орто-, мезо-, мета- и дипериодаты.
Соли иодной кислоты являются сильными окислителями, при нагревании разлагаются с выделением кислорода и иодида:
- NaIO4 → NaI + 2O2↑.
Периодаты могут быть получены окислением иодатов в щелочной среде сильными окислителями, например хлором:
- NaIO3 + 2NaOH + Cl2 → NaIO4 + 2NaCl + H2O.
Просмотров: 3112
|
|