Химия - Ионная сила раствора
01 марта 2011мера интенсивности электрического поля, создаваемого ионами в растворе. Полусумма произведений из концентрации всех ионов в растворе на квадрат их заряда. Формула впервые была выведена Льюисом:
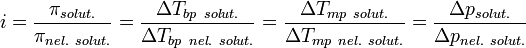 ,
,
где cB — молярные концентрации отдельных ионов, zB заряды ионов
Суммирование проводится по всем типам ионов, присутствующих в растворе. Если в растворе присутствуют два или несколько электролитов, то вычисляется общая суммарная ионная сила раствора.
Например, для раствора NaCl с концентрацией 0,001 моль/л, в котором присутствуют два вида однозарядных ионов Na и Cl с концентрациями также равными 0,001 моль/л, ионная сила будет вычисляться следующим образом:
- I = 0,5•c + z²•c) = 0,5 +²•c) = c
И ионная сила соответственно будет равна концентрации раствора:
- I = 0.5 = 0.5 = 0,001 моль/л
Это верно для раствора любого сильного электролита, состоящего из однозарядных ионов. Для электролитов, в которых присутствуют многозарядные ионы, ионная сила обычно превышает молярность раствора.
Ионная сила раствора имеет большое значение в теории сильных электролитов Дебая — Хюккеля. Основное уравнение этой теории показывает связь между коэффициентом активности иона ze и ионной силы раствора I в виде:
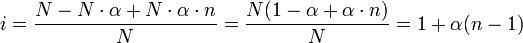 ,
,
где γ — коэффициент активности, А — постоянная, не зависящая от заряда иона и ионной силы раствора, но зависящая от диэлектрической постоянной растворителя и температуры.
Просмотров: 2298
|
|