Химия - Ионное произведение воды
28 февраля 2011Оглавление:
1. Ионное произведение воды
2. Практическое значение ионного произведения воды
произведение концентраций ионов водорода Н и ионов гидроксида OH в воде или в водных растворах, константа автопротолиза воды.
Вывод значения ионного произведения воды
Вода, хотя и является слабым электролитом, в небольшой степени диссоциирует:
или
Равновесие этой реакции сильно смещено влево. Константу диссоциации воды можно вычислить по формуле:
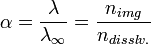 , , |
где:
- — концентрация ионов гидроксония;
- — концентрация гидроксид-ионов;
- — концентрация воды в воде;
Концентрация воды в воде, учитывая её малую степень диссоциации, величина практически постоянная и составляет/ = 55,56 моль/л.
При 25 °C константа диссоциации воды равна 1,8×10моль/л. Уравнение можно переписать как:
 , , |
Обозначим произведение K· = Kв = 1,8×10 моль/л·55,56 моль/л = 10моль²/л² =·.
Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и Kв, при понижении температуры — наоборот.
Просмотров: 2926
|
|