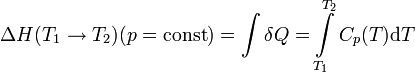Химия - Каломельный электрод
01 марта 2011Схемы подключения отопления частного дома.
электрод, использующийся в качестве электрода сравнения в гальванических элементах. Каломельный электрод состоит из платиновой проволочки, погружённой в каплю ртути, помещённую в насыщенный каломелью раствор хлорида калия определённой концентрации. Схематически его записывают следующим образом: Pt|Hg|Hg2Cl2|Cl.
Потенциал каломельного электрода
Уравнение окислительно-восстановительного процесса, протекающего в каломельном электроде, имеет вид
Уравнение Нернста для него может быть записано следующим образом:
Здесь 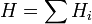 — стандартный электродный потенциал процесса,
— стандартный электродный потенциал процесса,  — активность ионов Hg в растворе. Поскольку каломель является малорастворимым соединением, активность ионов Hg связана с активностью хлорид-ионов через величину произведения растворимости Ksp:
— активность ионов Hg в растворе. Поскольку каломель является малорастворимым соединением, активность ионов Hg связана с активностью хлорид-ионов через величину произведения растворимости Ksp:
С учётом этого уравнение Нернста может быть записано следующим образом:
Потенциал каломельного электрода зависит, таким образом, только от температуры и активности хлорид-ионов. На практике обычно используется насыщенный раствор KCl; в этом случае потенциал насыщенного каломельного электрода зависит только от температуры и составляет 0.2412 В при 25 °C.
Достоинством насыщенных каломельных электродов является хорошая воспроизводимость потенциала. Работоспособны при температурах до 80 °C; при более высоких температурах начинается разложение каломели. Ввиду токсичности ртути, содержащейся в каломельных электродах, в настоящее время они применяются сравнительно редко.
Просмотров: 2844
|
|