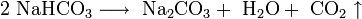Химия - Карбонат меди(II)
15 июля 2011Оглавление:
1. Карбонат меди(II)
2. Применение
Физические свойства
Карбонат меди — белое кристаллическое вещество, с слабым зеленоватым оттенком.
Получение
Непосредственно обменными реакциями в водных растворах между солями Cu и растворимыми карбонатами других металлов карбонат меди получить нельзя. Вследствие сильного гидролиза выделяются гидроксокарбонаты составов: CuCO3·Cu2 и 2CuCO3·Cu2, в зависимости от температуры и концентраций реагентов:
Нормальный карбонат меди СuСО3 получают обработкой основных карбонатов углекислым газом под давлением 4,6 МПа при 180 °C:
Химические свойства
Карбонат меди неустойчив и при нагревании разлагается:
Как и все карбонаты легко реагируют с кислотами с образованием соответствующих солей меди и выделением диоксида углерода:
Водный раствор аммиака и цианидов металлов растворяют карбонат меди с образованием аммиакатов или цианокомплексов Cu:
Просмотров: 3111
|
|