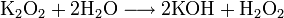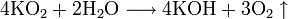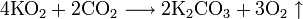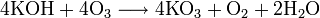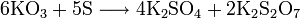Химия - Кислород - Химические свойства
01 марта 2011Оглавление:
1. Кислород
2. История открытия
3. Происхождение названия
4. Получение
5. Физические свойства
6. Химические свойства
7. Применение
8. Биологическая роль кислорода
9. Изотопы
Сильный окислитель, взаимодействует практически со всеми элементами, образуя оксиды. Степень окисления −2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры. Пример реакций, протекающих при комнатной температуре:
Окисляет соединения, которые содержат элементы с не максимальной степенью окисления:
Окисляет большинство органических соединений:
При определённых условиях можно провести мягкое окисление органического соединения:
Кислород не окисляет Au и Pt, галогены и инертные газы.
Кислород образует пероксиды со степенью окисления −1.
- Например, пероксиды получаются при сгорании щелочных металлов в кислороде:
- Некоторые оксиды поглощают кислород:
- По теории горения, разработанной А. Н. Бахом и К. О. Энглером, окисление происходит в две стадии с образованием промежуточного пероксидного соединения. Это промежуточное соединение можно выделить, например, при охлаждении пламени горящего водорода льдом, наряду с водой, образуется перекись водорода:
Надпероксиды имеют степень окисления −1/2, то есть один электрон на два атома кислорода. Получают взаимодействием пероксидов с кислородом при повышенных давлении и температуре:
- Калий K, рубидий Rb и цезий Cs реагируют с кислородом с образованием надпероксидов:
Озониды содержат ион O3 со степенью окисления −1/3. Получают действием озона на гидроксиды щелочных металлов:
Ион диоксигенил O2 имеет степень окисления +1/2. Получают по реакции:
Фториды кислорода
- Дифторид кислорода, OF2 степень окисления +2, получают пропусканием фтора через раствор щелочи:
- Монофторид кислорода, O2F2, нестабилен, степень окисления +1. Получают из смеси фтора с кислородом в тлеющем разряде при температуре −196 °C.
- Пропуская тлеющий разряд через смесь фтора с кислородом при определённых давлении и температуре получаются смеси высших фторидов кислорода O3F2, О4F2, О5F2 и О6F2.
- Квантовомеханические расчёты предсказывают устойчивое существование иона трифторгидроксония OF3. Если этот ион действительно существует, то степень окисления кислорода в нём будет равна +4.
Кислород поддерживает процессы дыхания, горения, гниения.
В свободном виде элемент существует в двух аллотропных модификациях:O2 и O3.
Просмотров: 13896
|
|