Химия - Концентрация растворов - Формулы перехода от одних выражений концентраций растворов к другим
01 марта 2011Оглавление:
1. Концентрация растворов
2. Объёмная доля
3. Нормальная концентрация
4. Моляльность
5. Другие способы выражения концентрации растворов
6. Формулы перехода от одних выражений концентраций растворов к другим
7. Наиболее распространённые единицы
От массовой доли к молярности:
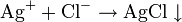 ,
,
где:
- ρ — плотность раствора, г/л;
- ω — массовая доля растворенного вещества в долях от 1;
- M1 — молярная масса растворенного вещества, г/моль.
От молярности к нормальности:
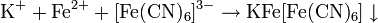 ,
,
где:
- M — молярность, моль/л;
- z — число эквивалентности.
От массовой доли к титру:
 ,
,
где:
- ρ — плотность раствора, г/л;
- ω — массовая доля растворенного вещества в долях от 1;
От молярности к титру:
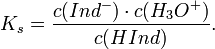 ,
,
где:
- M — молярность, моль/л;
- M1 — молярная масса растворенного вещества, г/моль.
От молярности к моляльности:
 ,
,
где:
- M — молярность, моль/л;
- ρ — плотность раствора, г/мл;
- M1 — молярная масса растворенного вещества, г/моль.
От моляльности к мольной доле:
 ,
,
где:
- mi — моляльность, моль/кг;
- M2 — молярная масса растворителя, г/моль.
Просмотров: 11942
|
|