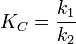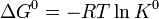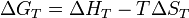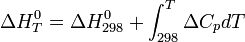Химия - Криоскопия
28 февраля 2011Криоскопия — метод исследования растворов, в основе которого лежит измерение понижения температуры замерзания раствора по сравнению с температурой замерзания чистого растворителя. Был предложен Ф. Раулем в 1882 году.
Давление пара над раствором нелетучего вещества практически полностью определяется давлением пара растворителя и может быть выражено уравнением:
- где x1 — мольная доля растворителя.
Видно, что оно ниже, чем давление пара над чистым растворителем, и снижается с ростом концентрации растворенного вещества.
В то же время при замерзании раствора давление пара над твердой фазой должно быть равно давлению пара над жидкостью. Если при замерзании раствора выделяется чистый растворитель, то давление пара над жидким раствором должно быть равно давлению пара над твердым чистым растворителем. Как было показано выше, давление пара над раствором ниже давления пара над чистым жидким растворителем, а следовательно, и соответствующее температуре замерзания равновесие для раствора будет устанавливаться при меньших температурах, чем для чистого растворителя. Это явление имеет важное значение в природе и технике.
Из приведенного выше выражения, с учетом уравнения Клапейрона — Клаузиуса можно показать, что изменение температуры замерзания ΔTcr для разбавленных растворов может быть рассчитано по формуле:
- где ΔHcr — энтальпия замерзания;
- M1 — молярная масса растворителя;
- n2 — моляльная концентрация растворенного вещества.
Здесь выражение в квадратных скобках зависит только от природы растворителя — это так называемая криоскопическая постоянная растворителя k:
Для воды k = 1,84 K, для железа 110 K.
Измеряя ΔTcr, можно определить молярную массу растворенного вещества, в соответствии с выражением:
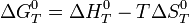
- где a — число граммов растворенного вещества, приходящееся на 1000 граммов растворителя.
Криоскопия может быть использована для определения активности растворителя, в соответствии с соотношением:
Кроме того, с помощью криоскопии можно определять степень диссоциации слабых электролитов, чистоту вещества, изучать комплексообразование в растворах и пр.
Просмотров: 3551
|
|