Химия - Марганцовая кислота
01 марта 2011Оглавление:
1. Марганцовая кислота
2. Получение
сильная неорганическая кислота с химической формулой HMnO4. В чистом виде не выделена, существует в виде раствора. Соли марганцовой кислоты называются перманганаты. Самым известным производным марганцовой кислоты является перманганат калия.
Физические свойства
Марганцовая кислота не выделена в свободном виде. Максимальная концентрация в водном растворе составляет 20 %. Растворы марганцовой кислоты имеют фиолетовую окраску. При температуре ниже 20 °C образует кристаллогидрат 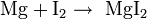 , имеющий ионное строение
, имеющий ионное строение 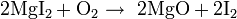 .
.
Химические свойства
Марганцовая кислота в растворе медленно разлагается, при этом выделяется кислород и выпадает осадок диоксида марганца:
Проявляет общие для сильных кислот свойства, например вступает в реакции нейтрализации с сильными и слабыми основаниями:
Марганцовая кислота, как и её соли, является очень сильным окислителем, например в реакциях:
Просмотров: 3428
|
|




