Химия - Молекула водорода - Энергия электронных состояний
01 марта 2011Оглавление:
1. Молекула водорода
2. Волновые функции
3. Энергия электронных состояний
4. Зависимость энергии основного состояния от расстояния между ядрами
5. Движение ядер в молекуле водорода
6. Пара- и ортоводород
Энергия электронных состояний находится усреднением гамильтониана на волновых функциях
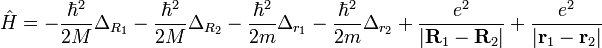 .
.
Для двух возможных волновых функций основного состояния она приобретает вид
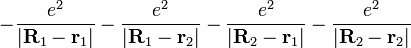 ,
,
где 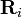 — расстояние между ядрами, E1s — значение энергии основного состояния атома водорода, S — интеграл перекрытия, который определяется выражением
— расстояние между ядрами, E1s — значение энергии основного состояния атома водорода, S — интеграл перекрытия, который определяется выражением
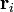 ,
,
Q — кулоновский интеграл, определяемый как
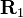 ,
,
A — обменный интерграл, равный
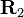
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
![\left. - \frac{1}{|\mathbf{r}_1 -\mathbf{R}_2|} - \frac{1}{|\mathbf{r}_2 -\mathbf{R}_1|} \right] dV_1 dV_2](/img/2827.png) .
.
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
Энергия моолекулы модорода состоит из удвоенной энергии атома водорода, энергии кулоновского отталкивания между ядрами и членов, определяющих взаимодействие электронов между собой и с другим ядром. В зависимости от спинового состояния в формуле для 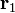 следует выбирать знак «+» или знак «-». Знак «+» отвечает синглетному состоянию, знак «-» — триплетному.
следует выбирать знак «+» или знак «-». Знак «+» отвечает синглетному состоянию, знак «-» — триплетному.
Величина Q — это средняя энергия кулоновского взаимодействия между двумя электронами и электронов с «чужим ядром». Величина A определяет вклад в энергию обменного взаимодействия, которая не имеет аналога в классической механике. Именно этот член определяет существенное различие между синглетными и триплетными состояниями.
Просмотров: 7268
|
|