Химия - Нитрат уранила
01 марта 2011Уранил азотнокислый, азотнокислая окись урана:
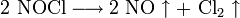 ;
; 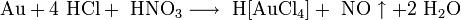 .
.
Молекулярный вес безводной формы 394,04; кристаллогидрата 502,13.
Роль металла в этой соли исполняет катион уранила 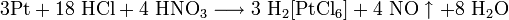 .
.
Кристаллы жёлтого цвета с зеленоватым отблеском, легко растворимые в воде. Водный раствор имеет кислую реакцию. Также растворим в этаноле, ацетоне и эфире, нерастворим в бензоле, толуоле и хлороформе.
При нагревании кристаллы плавятся и выделяют азотную кислоту и воду. Кристаллогидрат легко выветриваются на воздухе.
Характерная реакция — при действии аммиака образуется жёлтый осадок урановокислого аммония.
Обладает свойством дубить желатин. Ядовит.
Применение
В фотографии на основе солей серебра применяется как усилитель негативов и для тонирования готовых отпечатков. При этом часть серебра в изображении заменяется на железосинеродистый уранил  .
.
Реакции протекают по уравнениям:


В 60-ые годы XX века в СССР азотнокислый уранил свободно продавался в фотомагазинах.
Просмотров: 2307
|
|