Химия - Нитрилы - Химические свойства
28 февраля 2011Оглавление:
1. Нитрилы
2. Химические свойства
3. Способы получения
4. Анализ, применение и токсическое действие
Электронное строение нитрилов может быть представлено с помощью резонансных структур:
В соответствии с этим нитрилы вступают в реакции с электрофилами и нуклеофилами. Они также образуют комплексы с солями металлов с участием неподеленной пары электронов атома N; также известны комплексы, в которых нитрилы координированы к металлоцентру так называемым "боковым" образом за счет пи-системы данной функциональной группировки. Благодаря ненасыщенности и легкой поляризуемости цианогруппа активирует связанный с ней органический радикал, например облегчает диссоциацию связи С—Н у α-углеродного атома, а благодаря незначительному стерическому эффекту обеспечивает легкость реакций присоединения по связи C≡N.
В апротонной среде при низкой температуре нитрилы реагируют с галогеноводородами, образуя нитрилиевые соли и соли имидоилгалогенидов:
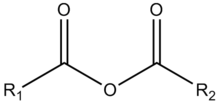
1. Образование карбоновых кислот из нитрилов.
Через образование нитрилиевых солей проходит гидратация нитрилов в кислой среде до амидов и далее гидролиз до карбоновых кислот:
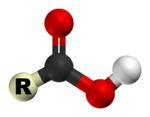
2. Получение амидов:
Амиды образуются также при гидратации нитрилов в щелочной среде и при действии на нитрилы Н2О2:
3. Реакции с олефинами, реакция Дильса-Альдера.
Нитрилы реагируют с олефинами и их функциональными, производными в присутствии кислотного катализатора, образуя замещенные амиды:
- R-CN + RRC=CHR + H2O
 RCONHRRCCH2R
RCONHRRCCH2R
вступают в реакцию Дильса–Альдера, например:
реакция Дильса–Альдера
При использовании в качестве диенофила перфторалкилцианидов RFCN или дициана реакция циклоприсоединения идет без катализатора с количественным выходом.
4. Реакция восстановления нитрилов.
Одна из важнейших реакций нитрилов — восстановление, протекающее ступенчато через промежуточное образование альдиминов:
— атомарный водород в качестве востановителя в момент выделения
Для восстановления нитрилов до аминов наиболее часто применяют каталитическое гидрирование на Pt или Pd при давлении 0,1—0,3 МПа и 20—50 °C или на Ni или Со при 10—25 МПа и 100—200 °C. Для подавления образования вторичных и третичных аминов добавляют NH3. В качестве восстановителей используют также металлический Na в этаноле, комплексные гидриды металлов и бора, например LiAlH4, NaBH4 и др. При восстановлении нитрилов SnCl2 в присутствии HCl образуются соли альдиминов, гидролиз которых приводит к альдегидам:
5. Реакции по органическому радикалу.
К важнейшим реакциям нитрилов по органическому радикалу относят: взаимодействие с карбонильными соединениями с образованием цианоолефинов, присоединение различных нуклеофилов к α,β-ненасыщенным нитрилам, например к акрилонитрилу, и полимеризацию:
Просмотров: 7655
|
|