Химия - Нитроны
28 февраля 2011Оглавление:
1. Нитроны
2. Синтез
Нитроны - N-оксиды иминов общей формулы RRC=NR. В зависимости от степени замещения при атоме углерода различают альдонитроны и кетонитроны. Изомерны с изонитронами.
Свойства
Нитроны - кристаллические вещества, в ИК-спектрах присутствует характеристическая полоса связи C=N при 1550-1620 см, в УФ-спектрах несопряженные нитроны поглощают в области λmax 240 нм. Слабые основания. Для нитронов, как и для оксимов, характерна цис — транс изомерия по связи C=N.
Реакционная способность
Строение нитронов может быть представлено как гибрид резонансных структур, основной вклад вносят 1,2-диполярная структура 1 и 1,3-диполярная структура 2:
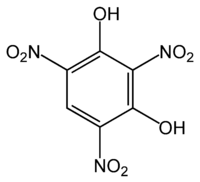
Кислородный атом нитронов является нуклеофильным центром, они протонируются по атому кислорода и образуют непрочные соли, алкилирование и ацилирование, продукты ацилирования обычно претерпевают перегруппировку в амиды:
Атом углерода нитронов электрофилен, они реагируют с нуклеофилами, образуя продукты 1,3-присоединения - N,N'-замещенные гидроксиламины:
- RRC=NR + HX
 RRC-NR
RRC-NR - X = CN, OH
Такое нуклеофильное присоединение воды к нитронам является первой стадией их гидролиза, ведущего к кетонам и замещенным гидроксиламинам.
Просмотров: 3245
|
|