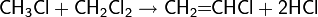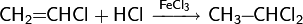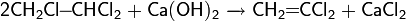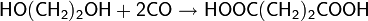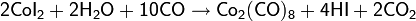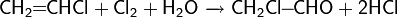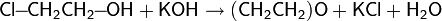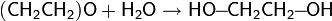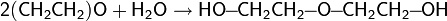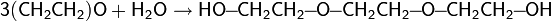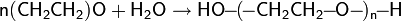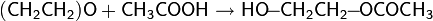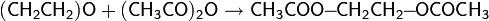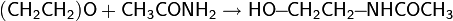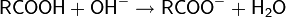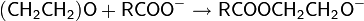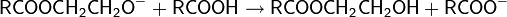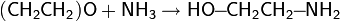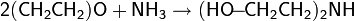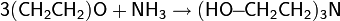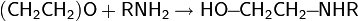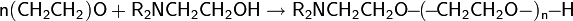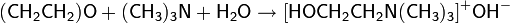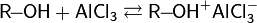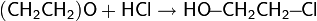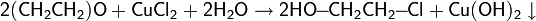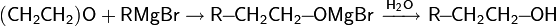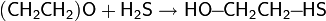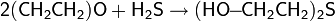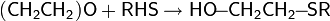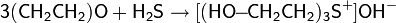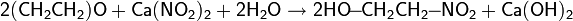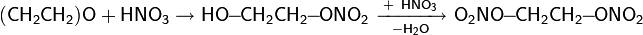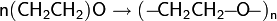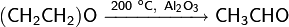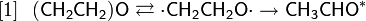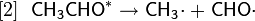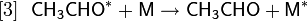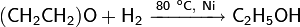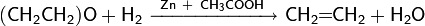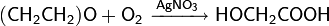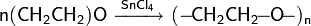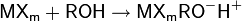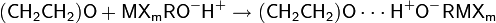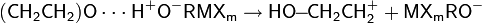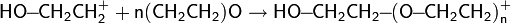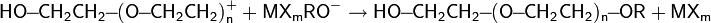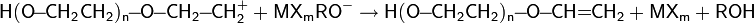Химия - Окись этилена - Химические свойства
01 марта 2011Оглавление:
1. Окись этилена
2. История открытия
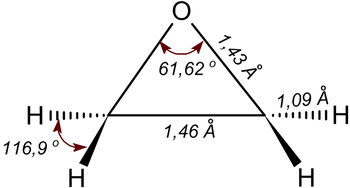
3. Строение и параметры молекулы
4. Физические свойства
5. Химические свойства
6. Лабораторные методы получения
7. Промышленное производство
8. Применение
9. Идентификация окиси этилена
10. Огне- и пожароопасность
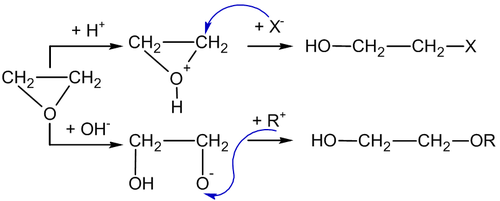
Благодаря особенностям молекулярной структуры, окись этилена является весьма реакционноспособным соединением и легко вступает в реакции с различными соединениями с разрывом C-O связи и раскрытием цикла. Для соединения наиболее характерны реакции с нуклеофилами, проходящие по механизму SN2 как в кислой, так и щелочной среде.
Общий вид реакций:
Далее будут рассмотрены наиболее типичные химические реакции с участием окиси этилена.
Присоединение воды и спиртов
Водные растворы окиси этилена довольно устойчивы и могут длительное время существовать без заметного протекания химической реакции, однако добавление небольшого количества кислоты сразу же приводит к образованию этиленгликоля даже при комнатной температуре:
Реакцию можно проводить и в газовой фазе, используя в качестве катализатора соли фосфорной кислоты.
Обычно, на практике, реакцию проводят при температуре около 60 °C при большом избытке воды, чтобы исключить реакцию образовавшегося этиленгликоля с этиленоксидом, в результате чего образуются ди- и триэтиленгликоли:
Использование щелочных катализаторов может привести к образованию полиэтиленгликоля:
Аналогично протекает реакция со спиртами, в результате чего образуются эфиры этиленгликоля:
Реакция с низшими спиртами протекает менее активно, чем с водой, требует более жёстких условий и присутствия кислотного или щелочного катализатора.
Реакция окиси этилена с высшими жирными спиртами, используемая для получения поверхностно-активных соединений, протекает в присутствии металлического натрия, гидроксида натрия или трифторида бора.
Присоединение карбоновых кислот и их производных
При взаимодействии окиси этилена в присутствии катализаторов с карбоновыми кислотами получаются неполные, а с ангидридами кислот — полные эфиры гликолей:
По аналогии возможно и присоединение амидов кислот:
Присоединение окиси этилена к высшим карбоновым кислотам производят при повышенной температуре и давлении в инертной атмосфере в присутствии щелочного катализатора — гидроксида или карбоната натрия. В качестве нуклеофила в реакции выступает карбоксилат-ион:
Присоединение аммиака и аминов
Окись этилена вступает в реакцию с аммиаком, образуя смесь моно-, ди- и триэтаноламина:
Аналогично может протекать реакция и с первичными и вторичными аминами:
Диалкиламиноэтанолы могут дальше реагировать с окисью этилена, образуя аминополиэтиленгликоли:
Триметиламин реагирует с окисью этилена в присутствии воды, образуя холин:
Ароматические первичные и вторичные амины также реагируют с окисью этилена, образуя соответствующие ариламиноспирты.
Присоединение галогеноводородов
Окись этилена легко реагирует с водными растворами галогеноводородов HCl, HBr и HI с образованием галогенгидринов:
Реакция с галогеноводородами в водном растворе конкурирует с кислотно катализируемой гидратацией окиси этилена, поэтому всегда в качестве побочного продукта будет образовываться этиленгликоль с примесью диэтиленгликоля. Для получения более чистого продукта, можно проводить реакцию в газовой фазе или в среде органического растворителя.
Этиленфторгидрин получают иначе: взаимодействием фтористого водорода с 5—6%-м раствором окиси этилена в диэтиловом эфире с содержанием воды 1,5—2 % при кипячении.
Галогенгидрины также можно получить, пропуская окись этилена через водные растворы галогенидов металлов:
Присоединение металлорганических соединений
Взаимодействие окиси этилена с магнийорганическими соединениями можно рассматривать как нуклеофильное замещение под действием карбаниона металлоорганического соединения. Конечным продуктом реакции будет первичный спирт:
Помимо реактивов Гриньяра по аналогичной схеме присоединяются и другие металлорганические соединения, например, алкиллитий:
Прочие реакции присоединения
Присоединение цианистого водорода
Этиленоксид легко вступает в реакцию с цианистым водородом с образованием этиленциангидрина:
Вместо HCN можно применять охлаждённый водный раствор цианида кальция:
Этиленциангидрин легко теряет воду, образуя акрилонитрил:
Присоединение сероводорода и меркаптанов
Взаимодействуя с сероводородом, окись этилена образует 2-меркаптоэтанол и тиодигликоль, с алкилмеркаптанами получается 2-алкилмеркаптоэтанол:
Избыток окиси этилена с водным раствором сероводорода приводит к трис-сульфония гидроксиду:
Присоединение азотистой и азотной кислот
Взаимодействие окиси этилена с водными растворами нитритов бария, кальция, магния или цинка, а также с раствором нитрита натрия с углекислым газом, приводит к образованию 2-нитроэтанола:
Реакция окиси этилена с азотной кислотой приводит к моно- и динитрогликолю:
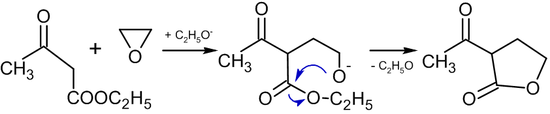
Реакция с соединениями, содержащими активную метиленовую группу
Реакция окиси этилена с соединениями, содержащими активную метиленовую группу, в присутствии алкоголятов приводит к образованию бутиролактонов:
Присоединение к ароматическим соединениям
Окись этилена вступает в реакцию Фриделя — Крафтса с бензолом с образованием фенилэтилового спирта:
Проводя реакцию в других условиях, можно получить в одну стадию стирол.
Реакции синтеза краун-эфиров
С помощью окиси этилена можно получить ряд многочленных гетероциклических соединений, известных как краун-эфиры.
Один из известных методов заключается в катионной циклополимеризации окиси этилена с ограничением размера образующегося цикла:
Для подавления образования побочных линейных полимеров используют метод высокого разбавления — реакцию проводят в сильно разбавленном растворе.
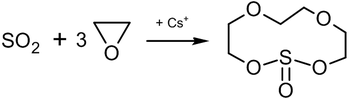
Интересной является реакция окиси этилена с SO2 в присутствии солей цезия, приводящая к образованию одиннадцатичленного гетероциклического соединения, обладающего комплексообразующими свойствами краун-эфиров:
Реакция изомеризации
При нагревании окиси этилена при температуре около 400 °C или 150—300 °C в присутствии катализаторов происходит изомеризация в ацетальдегид:
Радикальный механизм, предложенный Бенсоном для объяснения реакции, происходящей в газовой фазе, включает в себя следующие стадии:
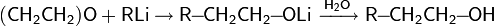
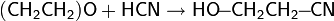
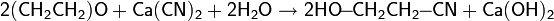
Частица представляет собой короткоживущую активированную молекулу ацетальдегида, избыточная энергия которой составляет примерно 355,6 кДж/моль, что на 29,3 кДж/моль больше энергии диссоциации связи C-C в ацетальдегиде.
Термическую изомеризацию окиси этилена в отсутствии катализатора невозможно провести селективно с образованием ацетальдегида, так как в этих условиях заметны параллельные радикальные реакции и существенна доля побочных продуктов.
Реакции восстановления
Окись этилена может быть подвергнута гидрированию с образованием этилового спирта в присутствии катализатора:
В качестве катализаторов прямого гидрирования могут выступать никель, платина и палладий. Также в качестве агентов гидрирования возможно использование алюмогидрида лития, боранов и некоторых других гидридов.
Окись этилена может также восстанавливаться водородом в момент выделения до этилена:
Аналогично реакция идёт в присутствии смеси алюмогидрида лития с хлоридом титана, хлорида железа с бутиллитием в среде тетрагидрофурана, а также некоторыми другими агентами.
Реакции окисления
Окись этилена может быть окислена в зависимости от условий до гликолевой кислоты или до диоксида углерода:
Глубокое газофазное окисление окиси этилена в реакторе при температуре 800—1000 К и давлении 0,1—1 МПа приводит к смеси продуктов, содержащей O2, H2, CO, CO2, CH4, C2H2, C2H4, C2H6, C3H6, C3H8, CH3CHO.
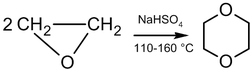
Реакции димеризации
В присутствии кислотных катализаторов можно провести димеризацию окиси этилена с образованием диоксана:
Механизм реакции выглядит следующим образом:
Реакция димеризации не является селективной, так как в ходе её проведения всегда образуются побочные продукты и, в частности, ацетальдегид.
Для ускорения и повышения селективности реакции можно использовать платиновые или платино-палладиевые катализаторы, а также элементарный йод вместе с сульфоланом.
Реакции полимеризации
Жидкая окись этилена под действием различных факторов может образовывать полиэтиленгликоли. Процесс полимеризации может иметь как радикальный, так и ионный механизм, но в практическом плане только последний имеет широкое использование.
Катионная полимеризация окиси этилена протекает под действием протонных кислот, кислот Льюиса, металлорганических соединений или более сложных, многокомпонентных составов:
Механизм реакции выглядит следующим образом.
На первой стадии происходит инициация катализатора под действием алкил- или ацилгалогенида или соединения с активным атомом водорода, обычно воды, спирта или гликоля:
Образующийся активный комплекс вступает в реакцию с окисью этилена по SN2-механизму:
Обрыв цепи:
Анионная полимеризация окиси этилена протекает под действием оснований: алкоголятов, гидроксидов, карбонатов или других соединений щелочных или щёлочноземельных металлов.
Механизм реакции выглядит следующим образом:
Термическое разложение
Окись этилена термически устойчивое соединение — в отсутствии катализаторов до 300 °C она не подвергается деструкции и только после 570 °C начинается заметный процесс экзотермического разложения, протекающий по радикальному механизму. На первом этапе происходит изомеризация, однако с увеличением температуры радикальный процесс ускоряется и в качестве продуктов реакции получается газовая смесь, содержащая помимо ацетальдегида: этан, этилен, метан, водород, оксид углерода, кетен, формальдегид.
Высокотемпературный пиролиз при повышенном давлении в инертной среде приводит к более сложному составу газовой смеси, в котором дополнительно обнаруживаются ацетилен и пропан.
Инициация цепи, в отличие от реакции изомеризации, происходит в основном следующим образом:
Проводя термическую деструкцию окиси этилена в присутствии соединений переходных металлов в качестве катализаторов, можно не только уменьшить её температуру, но и получить в качестве основного продукта этилен, то есть фактически провести реакцию обратную синтезу окиси этилена прямым окислением.
Прочие реакции
Под действием тиоцианат-ионов или тиомочевины окись этилена превращается в тииран:
Пентахлорид фосфора, взаимодействуя с окисью этилена, образует дихлорэтан:
По аналогии дихлорпроизводные из окиси этилена можно получить действием SOCl2 и пиридином, трифенилфосфином и CCl4.
Трихлорид фосфора с окисью этилена образует хлорэтиловые эфиры фосфористой кислоты:
Продуктом реакции оксида этилена с хлорангидридами карбоновых кислот в присутствии иодида натрия является сложный йодэтильный эфир:
При нагревании окиси этилена с двуокисью углерода в среде неполярного растворителя при 100 °C в присутствии бис--никеля образуется этиленкарбонат:
В промышленности подобную реакцию проводят при повышенном давлении и температуре в присутствии четвертичных аммониевых или фосфониевых солей в качестве катализатора.
Реакция окиси этилена с формальдегидом в присутствии катализатора при температуре 80—150 °C приводит к образованию 1,3-диоксолана:
Если вместо формальдегида использовать другие альдегиды или кетоны, можно получить 2-замещённые 1,3-диоксоланы.
Каталитическое гидроформилирование окиси этилена приводит к образованию гидроксипропаналя и далее пропан-1,3-диола:
Просмотров: 27360
|
|