Химия - Оксид бария
28 февраля 2011Описание
Оксид бария при стандартных условиях представляет собой бесцветные кристаллы с кубической решёткой . Из-за высокой химической активности рекомендуется применять меры предосторожности.
Получение
1. Взаимодействие металлического бария с кислородом:

В этом случае наряду с оксидом бария образуется пероксид бария:
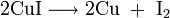
2. Разложение карбоната бария при нагревании:
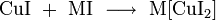
Химические свойства
1. Энергичное взаимодействие с водой с образованием щёлочи и выделением тепла:
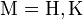
2. Взаимодействие с кислотными оксидами с образованием соли:
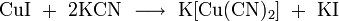
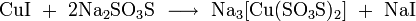
3. Взаимодействие с кислотами с образованием соли и воды:
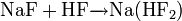
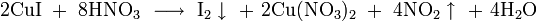
4. Взаимодействие с кислородом при температуре около 600 °C с образованием пероксида:
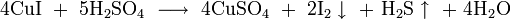
5. Восстановление до металла при нагревании с магнием, цинком, алюминием и кремнием .
Применение
Оксид бария применяется для покрытия катодов, в экранно-лучевых трубках, для производства некоторых видов стекла, например , оптического. В некоторых реакциях используется как катализатор.
Просмотров: 2381
|
|