Химия - Оксид натрия
28 февраля 2011Оглавление:
1. Оксид натрия
2. Применение
Описание
Оксид натрия представляет собой бесцветные кристаллы кубической сингонии. Хранить оксид натрия Na2O лучше всего в безводном бензоле.
Получение
1. Взаимодействие металлического натрия с кислородом:
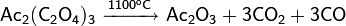
Чистый оксид натрия получить непосредственным окислением натрия нельзя, так как образуется смесь, состоящая из 20 % оксида натрия и 80 % пероксида натрия:
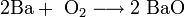
2. Взаимодействие металлического натрия с нитратом натрия:
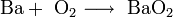
3. Прокаливание пероксида натрия с избытком натрия:
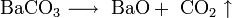
4. Прокаливанием карбоната натрия при 1000 °C, получаемого в свою очередь прокаливанием гидрокарбоната натрия при 200 °C.
Химические свойства
1. Взаимодействие с водой с образованием щёлочи:
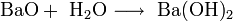
2. Взаимодействие с кислотными оксидами с образованием соли:
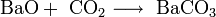
3. Взаимодействие с кислотами с образованием соли и воды:
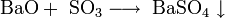
Просмотров: 4269
|
|