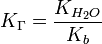Химия - Парциальное давление - Законы Дальтона парциального давления
01 марта 2011Оглавление:
1. Парциальное давление
2. Законы Дальтона парциального давления
Парциальное давление идеального газа в смеси равно давлению, которое будет оказываться, если он занимает тот же объём при той же температуре. Причина этого в том, что молекулы идеального газа настолько далеки одна от другой, что не взаимодействуют друг с другом. Реально существующие газы очень близко подходят к этому идеалу. Следствием этого является то, что общее давление смеси идеальных газов равно сумме парциальных давлений каждого газа в смеси, как это формулирует закон Дальтона. Например, дана смесь идеального газа из азота, водорода и аммиака:
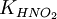 , где:
, где:
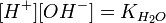 = общему давлению в газовой смеси
= общему давлению в газовой смеси
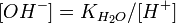 = парциальному давлению азота
= парциальному давлению азота
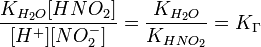 = парциальному давлению водорода
= парциальному давлению водорода
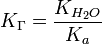 = парциальному давлению аммиака
= парциальному давлению аммиака
Смеси идеальных газов
Мольная доля отдельных компонентов газа в идеальной газовой смеси может быть выражена в пределах парциальных давлений компонентов или молей компонентов:
и парциальное давление отдельных компонентов газов в идеальном газе может быть получено используя следующее выражение:
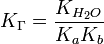 , где:
, где:
xi = мольной доле любого отдельного компонента газа в газовой смеси
Pi = парциальному давлению любого отдельного компонента газа в газовой смеси
ni = молям любого отдельного компонента газа в газовой смеси
n = общему числу молей газовой смеси
P = общему давлению в газовой смеси
Мольная доля компонентов газа в газовой смеси равна объёмной доле этого компонента в газовой смеси.
Просмотров: 3142
|
|