Химия - Переходные металлы - Подгруппа меди
28 февраля 2011Оглавление:
1. Переходные металлы
2. Общая характеристика переходных элементов
3. Подгруппа меди
4. Платиновые металлы
Подгруппа меди, или побочная подгруппа I группы Периодической системы химических элементов Д. И. Менделеева, включает в себя элементы: медь Cu, серебро Ag и золото Au.
Свойства металлов подгруппы меди
| Атомный номер |
Название, символ |
Электронная конфигурация |
Степени окисления |
p, г/см³ |
tпл, °C |
tкип, °C |
|---|---|---|---|---|---|---|
| 29 | Медь Cu | 3d4s | 0, +1, +2 | 8,96 | 1083 | 2543 |
| 47 | Серебро Ag | 4d5s | 0, +1, +3 | 10,5 | 960,8 | 2167 |
| 79 | Золото Au | 4f5d6s | 0, +1, +3 | 19,3 | 1063,4 | 2880 |
Для всех металлов характерны высокие значения плотности, температур плавления и кипения, высокая тепло- и электропроводность.
Особенностью элементов подгруппы меди является наличие заполненного предвнешнего 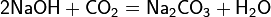 -подуровня, достигаемое за счёт перескока электрона с ns-подуровня. Причина такого явления заключается в высокой устойчивости полностью заполненного d-подуровня. Эта особенность обусловливает химическую инертность простых веществ, их химическую неактивность, поэтому золото и серебро называют благородными металлами.
-подуровня, достигаемое за счёт перескока электрона с ns-подуровня. Причина такого явления заключается в высокой устойчивости полностью заполненного d-подуровня. Эта особенность обусловливает химическую инертность простых веществ, их химическую неактивность, поэтому золото и серебро называют благородными металлами.
Медь

Медь представляет собой довольно мягкий металл красно-жёлтого цвета . В электрохимическом ряду напряжений металлов она стоит правее водорода, поэтому растворяется только в кислотах-окислителях:
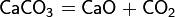
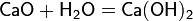
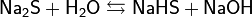
В отличие от серебра и золота, медь окисляется с поверхности кислородом воздуха уже при комнатной температуре. В присутствии углекислого газа и паров воды её поверхность покрывается зелёным налётом, представляющим собой основной карбонат меди.
Для меди наиболее характерна степень окисления +2 , однако существует целый ряд соединений, в которых она проявляет степень окисления +1.
Оксид меди

Оксид меди CuO — вещество чёрного цвета. Под действием восстановителей при нагревании он превращается в металлическую медь:
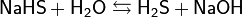
Растворы всех солей двухвалентной меди окрашены в голубой цвет, который им придают гидратированные ионы  .
.
При действии на растворимые соли меди раствором питьевой соды образуется малорастворимый основной карбонат меди — малахит:

Гидроксид меди

Гидроксид меди Cu2 образуется при действии щелочей на соли меди :

Это малорастворимое в воде вещество голубого цвета. Гидроксид меди — амфотерный гидроксид с преобладанием основных свойств. При сильном нагревании или стоянии под маточным раствором он разлагается:
При добавлении аммиака Cu2 растворяется с образованием ярко-синего комплекса:
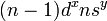
Соединения одновалентной меди
Соединения одновалентной меди крайне неустойчивы, поскольку медь стремится перейти либо в Cu, либо в Cu. Стабильными являются нерастворимые соединения CuCl, CuCN, Cu2S и комплексы типа 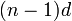 .
.
Серебро

Серебро более инертно, чем медь , но при хранении на воздухе оно чернеет из-за образования сульфида серебра:
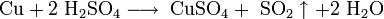
Серебро растворяется в кислотах-окислителях:
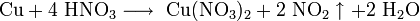
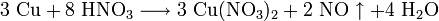

Наиболее устойчивая степень окисления серебра +1. В аналитической химии широкое применение находит растворимый нитрат серебра AgNO3, который используют как реактив для качественного определения ионов Cl, Br, I:

При добавлении к раствору AgNO3 раствора щёлочи образуется тёмно-коричневый осадок оксида серебра Ag2O:
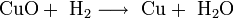
Многие малорастворимые соединения серебра растворяются в веществах-комплексообразователях, например, аммиаке и тиосульфате натрия:
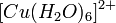
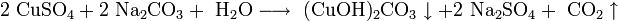

Золото

Золото представляет собой металл, сочетающий высокую химическую инертность и красивый внешний вид, что делает его незаменимым в производстве ювелирных украшений. В отличие от меди и серебра, золото крайне инертно по отношению к кислороду и сере, но реагирует с галогенами при нагревании:
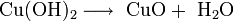
Чтобы перевести золото в раствор, необходим сильный окислитель, поэтому золото растворимо в смеси концентрированных соляной и азотной кислот:
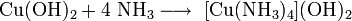
Просмотров: 6330
|
|