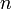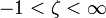Химия - Правило фаз
01 марта 2011Оглавление:
1. Правило фаз
2. Математическая интерпретация правила фаз
Правило фаз — соотношение, связывающее число веществ, фаз и степеней свободы в гетерогенной системе.
Уравнение Гиббса
Правило фаз записывается следующим образом:
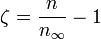
- где j — число фаз;
- v — число степеней свободы, то есть независимых параметров, которые полностью определяют состояние системы при равновесии и которые можно менять без изменения числа и природы фаз;
- k — число компонентов системы — число входящих в систему индивидуальных веществ за вычетом числа химических уравнений, связывающих эти вещества. Иначе говоря, это минимальное количество веществ, из которых можно приготовить каждую фазу системы.
- n — число переменных, характеризующих влияние внешних условий на равновесие системы.
При переменных давлении и температуре правило фаз сводится к выражению:
В случае однокомпонентной системы оно упрощается до:
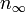 ,
,
Отсюда видно, например, что в однокомпонентной системе три фазы могут сосуществовать при числе степеней свободы v, равном нулю, то есть при фиксированных давлении и температуре, что соответствует тройной точке на фазовой диаграмме. Две фазы сосуществуют при произвольном измененнии либо давления, либо температуры, когда вторая из этих переменных не является независимой, то есть двухфазному равновесию на фазовой диаграмме соответствует линия. Если фаза одна, число степеней свободы системы равно двум, то есть температура и давление могут менятся независимо в пределах некоторой области на фазовой диаграмме — пока система не окажется на одной из линий двухфазного равновесия.
Иногда правило фаз записывают следующим образом:
то есть при равновесии число фаз в системе меньше либо равно числу компонентов плюс 2.
Просмотров: 2658
|
|