Химия - Правило Хунда
01 марта 2011Оглавление:
1. Правило Хунда
2. Мнемоническое правило
Правило Хунда определяет порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: суммарное значение спинового квантового числа электронов данного подслоя должно быть максимальным.
Это означает, что в каждой из орбиталей подслоя заполняется сначала один электрон, а только после исчерпания незаполненных орбиталей на эту орбиталь добавляется второй электрон. При этом на одной орбитали находятся два электрона с полуцелыми спинами противоположного знака, которые спариваются и, в результате, суммарный спин орбитали становится равным нулю.
Другая формулировка: Ниже по энергии лежит тот атомный терм, для которого выполняются два условия.
- Мультиплетность максимальна
- При совпадении мультиплетностей суммарный орбитальный момент L максимален.
Разберём это правило на примере заполнения орбиталей p-подуровня p-элементов второго периода:
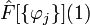
Как видно, сначала появляется один электрон на 2px-орбитали, затем один электрон на 2py-орбитали, после этого один электрон на 2pz-орбитали, затем появляются парные электроны на 2px-, 2py- и 2pz-орбиталях.
Просмотров: 3755
|
|