Химия - Приближение Борна Оппенгеймера - Обоснование применимости
01 марта 2011Оглавление:
1. Приближение Борна Оппенгеймера
2. Обоснование применимости
Уравнение Шрёдингера для молекулы с N ядрами и n электронами и волновой функцией приближения имеет вид
|
|
) |
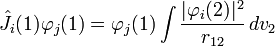 — постоянная Дирака; Vnuc,nuc — энергия отталкивания ядер; Vnuc,el — энергия притяжения электронов к ядрам; Vel,el — энергия отталкивания электронов.
— постоянная Дирака; Vnuc,nuc — энергия отталкивания ядер; Vnuc,el — энергия притяжения электронов к ядрам; Vel,el — энергия отталкивания электронов.
Электронная функция Ψel определяется как собственная функция оператора Hel:
|
HelΨel = EelΨel, |
) |
где Eel — электронная энергия, обусловленная движением n электронов в поле N ядер молекулы, плюс энергия взаимодействия между ядрами Vnuc,nuc. Величину Eel называют адиабатическим электронным термом молекулы или адиабатическим потенциалом.
Учитывая что
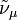 ;
;
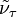 ,
,
уравнение приобретает вид:
|
|
) |
Пренебрегая выражением в первых круглых скобках получаем уравнение:
Разделив все члены этого уравнения на Ψel и принимая во внимание получается уравнение для определения Ψnuc:
- Ψnuc = ΕΨnuc.
Пренебрежение скобками в уравнении означает, что электронная волновая функция Ψel должна быть настолько медленно меняющейся функцией ядерных координат R, что можно пренебречь ее первой и второй производными по этим координатам. М. Борн и Р. Оппенгеймер в 1927 году впервые показали, что электронные волновые функции обычно подчиняются этому условию с требуемой степенью точности.
Для случая устойчивых многоатомных молекул существует простой критерий применимости приближения Б.-О.
|
|
) |
где ν — наибольшая из частот малых колебаний ядер вблизи точки равновесия,  и
и 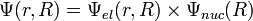 — энергии двух соседних электронных состояний. Критерий обычно выполняется для многих молекул, вследствие этого расчеты физических характеристик молекул, основанные на приближении Б.-О., позволяют получить данные, хорошо согласующиеся с экспериментальными результатами. Ошибка, вносимая при использовании такого приближения, намного меньше ошибок, вносимых другими приближениями. Это позволяет ограничиваться решением только одного электронного уравнения. Поправки для возбужденных электронных состояний значительнее, но обычно ими также можно пренебречь по сравнению с неточностями, обусловленными приближенным решением электронного уравнения Шрёдингера.
— энергии двух соседних электронных состояний. Критерий обычно выполняется для многих молекул, вследствие этого расчеты физических характеристик молекул, основанные на приближении Б.-О., позволяют получить данные, хорошо согласующиеся с экспериментальными результатами. Ошибка, вносимая при использовании такого приближения, намного меньше ошибок, вносимых другими приближениями. Это позволяет ограничиваться решением только одного электронного уравнения. Поправки для возбужденных электронных состояний значительнее, но обычно ими также можно пренебречь по сравнению с неточностями, обусловленными приближенным решением электронного уравнения Шрёдингера.
Просмотров: 3638
|
|
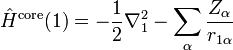
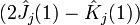
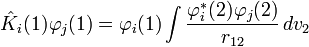
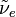
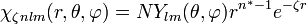
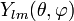
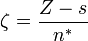
 ,
,