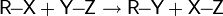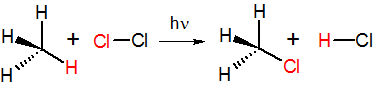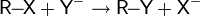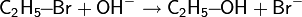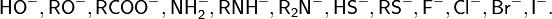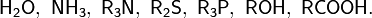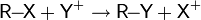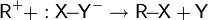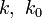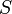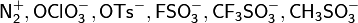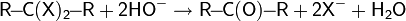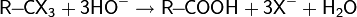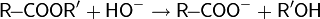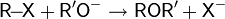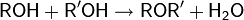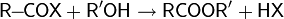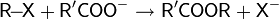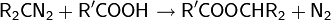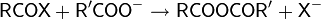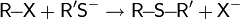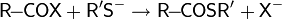Химия - Реакции нуклеофильного замещения - Реакции алифатического нуклеофильного замещения
28 февраля 2011Оглавление:
1. Реакции нуклеофильного замещения
2. Реакции алифатического нуклеофильного замещения
3. Реакции ароматического нуклеофильного замещения
Реакции SN1
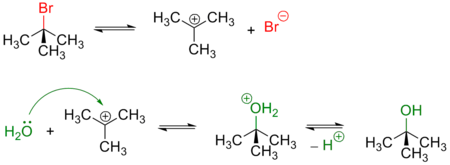
Механизм реакции SN1 или реакции мономолекулярного нуклеофильного замещения включает следующие стадии:
1. Ионизация субстрата с образованием карбкатиона:
- R−X → R + X
2. Нуклеофильная атака карбкатиона:
- R + Y → R−Y
или:
- R + Y−Z → R−Y−Z
3. Отщепление катиона:
- R−Y−Z → R−Y + Z
Примером реакции SN1 является гидролиз трет-бутилбромида:
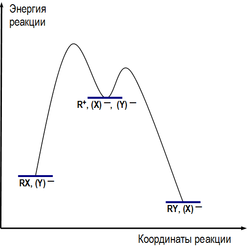
Условный энергетический профиль реакции мономолекулярного нуклеофильного замещения представлен на диаграмме.

Скорость реакции SN1 не зависит от концентрации нуклеофила и прямо пропорциональна концентрации субстрата:
- Скорость реакции = k ×
Так как в процессе реакции образуется карбкатион, его атака нуклеофилом может происходить с обеих сторон, что приводит к рацемизации образующегося продукта.
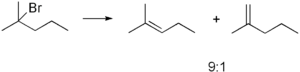
Важно иметь в виду, что SN1 механизм реализуется только в случае относительной устойчивости промежуточного карбкатиона, поэтому по такому пути, обычно, реагируют только третичные3C-X) и вторичные2CH-X) алкилпроизводные.
Реакции SN2

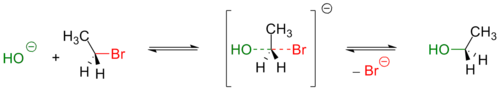
Механизм реакции SN2 или реакции бимолекулярного нуклеофильного замещения происходит в одну стадию, без промежуточного образования интермедиата. При этом атака нуклеофила и отщепление уходящей группы происходит одновременно:
- R−X + Y → → R−Y + X
Примером реакции SN2 является гидролиз этилбромида:
Условный энергетический профиль реакции мономолекулярного нуклеофильного замещения представлен на диаграмме.
Скорость реакции SN2 зависит как от концентрации нуклеофила, так и концентрации субстрата:
- Скорость реакции = k × ×
Так как в процессе реакции атака нуклеофилом может происходить только с одной стороны, результатом реакции является стехиометрическая инверсия образующегося продукта.
Ещё в 1895 году году этот эффект обнаружил латышский химик Пауль Вальден, однако он не смог его объяснить. В 1935 году Хьюз исследую реакцию оптически активного 2-йодоктана с йодид-ионом обнаружил, что реакция имеет общий второй кинетический порядок и первый по каждому из реагентов, а также что скорость рацемизации в два раза выше скорости внедрения йода в молекулу йодоктана. Так было сформулировано стехиометрическое SN2 правило:
В реакциях бимолекулярного нуклеофильного замещения атакующий нуклеофил стехиометрически инвертирует молекулу, в которой он замещает уходящую группу.
Сравнение реакций SN1 и SN2
| Сравнительный фактор | SN1 | SN2 |
|---|---|---|
| Скорость реакции | k × | k × × |
| Стереохимический результат | рацемизация | инверсия |
| Предпочтительный растворитель | полярный протонный | полярный апротонный |
|
Влияние структуры субстрата на скорость реакции
|
||
| CH3-Х | реакция не идёт | очень хорошо |
| R-CH2-X | реакция не идёт | хорошо |
| R2CH-X | реакция идёт | реакция идёт |
| R3C-X | очень хорошо | реакция не идёт |
| R-CH=CH-CH2-X | реакция идёт | хорошо |
| С6H5-CH2-X | реакция идёт | хорошо |
| R-CO-CH2-X | реакция не идёт | отлично |
| R-O-CH2-X | отлично | хорошо |
| R2N-CH2-X | отлично | хорошо |
Реакции смешанного типа SN1 — SN2
Не для всех реакций можно чётко определить механизм, по которому они протекают, так как чистый SN1 или SN2 являются всего лишь идеальными модельными случаями. Следует помнить, что один и тот же субстрат может реагировать с одним и тем же нуклеофилом, в зависимости от условий реакции и растворителя, как по механизму SN1, так и SN2.
Например, скорость гидролиза 2-бромпропана описывается с учётом смешанного механизма его протекания:
- CH3−CHBr−CH3 + HO → CH3−CHOH−CH3 + Br
- Скорость реакции = k1 × + k2 × ×
Часто смешанный механизм провоцирует применение амбидентных нуклеофилов, то есть нуклеофилов, имеющих не менее двух атомов — доноров электронных пар
Если в субстрате имеется заместитель, находящийся рядом с атакуемым атомом и несущий свободную электронную пару, он может существенно увеличить скорость реакции нуклеофильного замещения и повлиять на её механизм. В этом случае говорят об анхимерном содействии соседней группы
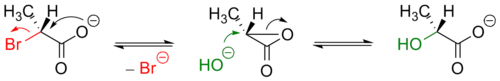
Примером анхимерного содействия может служить гидролиз 2-бромпропионата:
Несмотря на формальный механизм SN2, образующийся в ходе реакции продукт имеет ту же оптическую конфигурацию, что и исходный.
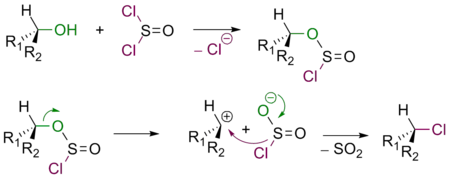
Реакции SNi
Механизм реакции SNi или реакции внутримолекулярного нуклеофильного замещения протекает в несколько стадий по аналогии с механизмом SN1, однако часть уходящей группы при этом атакует субстрат, отщепляясь от оставшейся части.
Общая схема реакции:
1. Ионизация субстрата:
2. Нуклеофильная атака:
На первом этапе субстрат диссоциирует с образованием т. н. контактной ионной пары. Компоненты такой пары находятся очень близко друг от друга, поэтому атака нуклеофила вынужденно происходит с той же стороны, где до этого находилась уходящая группа.
Реакции, протекающие по механизму SNi, крайне редки. Одним из примеров может служить взаимодействие спирта с SOCl2:
Из схемы видно, что в реакций SNi конфигурация реакционного центра остается неизменной.
Факторы, влияющие на реакционную способность
Влияние природы нуклеофила
Природа нуклеофила оказывает существенное влияние на скорость и механизм реакции замещения. Фактором, количественно описывающим это влияние является нуклеофильность — относительная величина, характеризующая способность влияния реагента на скорость химической реакции нуклеофильного замещения.
Нуклеофильность — величина кинетическая, т. е. есть влияет исключительно на скорость реакции. Этим она принципиально отличается от основности, которая является термодинамической величиной, и определяет положение равновесия.
В идеальном случае природа нуклеофила не влияет на скорость реакции SN1, так как лимитирующая стадия этого процесса от этого не зависит. В то же время, природа реагента может оказать влияние на ход процесса и конечный продукт реакции.
Для реакций SN2 можно выделить следующие принципы, по которым определяется влияние природы нуклеофила:
- Отрицательно заряженный нуклеофил всегда сильнее, чем его сопряженная кислота, при условии, что она также проявляет нуклеофильные свойства.
- При сравнении нуклеофилов, атакующие атомы которых находятся в одном периоде периодической системы им. Д. И. Менделеева, изменение их силы соответствует изменению их основности:
- Сверху вниз в периодической системе нуклеофильность обычно возрастает:
- Исключение из предыдущего пункта:
- Чем свободнее нуклеофил, тем он сильнее.
- Если в положении, соседствующем с атакуемым атомом имеются свободные электронные пары, нуклеофильность возрастает:
Следует иметь в виду, что нуклеофильность различных реагентов сравнивают по отношению к некоторому выбранному стандарту при условии соблюдения идентичности условий проведения реакции. На практике для реакций SN2 применяют уравнение Свена-Скотта:
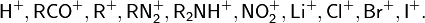 ,
,
где:
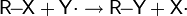 — константы скорости реакции субстрата с данным нуклеофилом и водой;
— константы скорости реакции субстрата с данным нуклеофилом и водой;
 — параметр чувствительности субстрата к изменению нуклеофила;
— параметр чувствительности субстрата к изменению нуклеофила;
 — параметр нуклеофильности.
— параметр нуклеофильности.
Влияние уходящей группы
Фактором, количественно описывающим влияние уходящей группы является относительная величина, характеризующая способность влияния нуклеофуга на скорость химической реакции нуклеофильного замещения.
Для описания нуклеофугности, обычно, трудно подобрать один параметр, который исчерпывающе определил бы зависимость скорости реакции от природы уходящей группы. Часто, в качестве меры нуклеофугности для реакций SN1 служат константы сольволиза.
Эмпирически можно руководствоваться следующим правилом — уходящая группа отщепляется тем легче, тем стабильнее она как самостоятельная частица.
Хорошими нуклеофугами являются следующие группы:

Влияние растворителя
Очевидно, что для реакций SN1, чем выше полярность растворителя, тем выше скорость реакции замещения. Если же субстрат несёт положительный заряд, наблюдается обратная зависимость — повышение полярности растворителя замедляет реакцию. Сравнивая протонные и апротонные растворители, следует отметить, что если растворитель способен образовывать водородную связь с уходящей группой, он увеличивает скорость для нейтральных субстратов.
Для реакций SN2 влияние растворителя оценить сложнее. Если в переходном состоянии заряд распределён аналогично исходному состоянию или снижен, апротонные полярные растворители замедляют реакцию. Если такой заряд возникает только в переходном состоянии, полярные растворители реакцию ускоряют. Протонные полярные растворители способны образовывать связь с анионами, что затрудняет протекание реакции.
На скорость реакции в апротонных растворителях также оказывает влияние и размер атакующего атома: малые атомы обладают большей нуклеофильностью.
Обобщая сказанное, можно эмпирически отметить: для большинства субстратов при увеличении полярности растворителя скорость SN1 реакций растёт, а SN2 — снижается.
Иногда оценивают влияние растворителя рассматривая его ионизирующую силу, используя уравнение Уинстейна-Грюнвальда:
где: 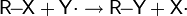 — константы скорости сольволиза стандартного субстрата в заданном и стандартном растворителе.
— константы скорости сольволиза стандартного субстрата в заданном и стандартном растворителе.
 — параметр чувствительности субстрата к ионизирующей силе растворителя.
— параметр чувствительности субстрата к ионизирующей силе растворителя.
Значение Y для некоторых растворителей: вода: 3,493; муравьиная кислота: 2,054; метанол: −1,090; этанол: −2,033; диметилформамид: −3,500
Существует и альтернативный I-параметр, введённый в 1969 году Другаром и Декрооком. Он аналогичен Y-фактору, но в качестве снандарта была выбрана SN2 реакция между три-н-пропиламином и йодистым метилом при 20°С.
| Название | Реакция |
|---|---|
| Нуклеофилы: H2O, HO, ROH, RO | |
| Гидролиз алкилгалогенидов | 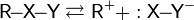
|
| Гидролиз ацилгалогенидов | 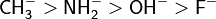 |
| Гидролиз сложных эфиров | 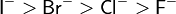 |
| Алкилирование алкилгалогенидами | 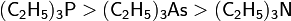 |
| Образование и переэтерификация простых эфиров | 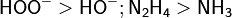 |
| Образование и переэтерификация сложных эфиров | 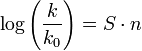
|
| Нуклеофилы: RCOOH, RCOO | |
| Реакции алкилирования | 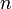
|
| Реакции ацилирования | 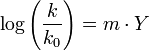
|
| Нуклеофилы: H2S, SH, SR | |
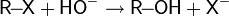
|
|
| Нуклеофилы: NH3, RNH2, R2NH | |
| Алкилирование аминов | 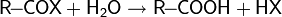
|
| Ацилирование аминов |
|
| Нуклеофилы: галогены и галогенпроизводные | |
| Реакция обмена галогенами | 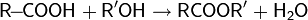 |
| Получение алкилгалогенидов из спиртов | 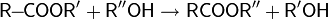
|
| Получение алкилгалогенидов из простых и сложных эфиров | 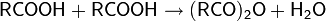
|
| Получение ацилгалогенидов | 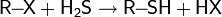
|
| Прочие нуклеофилы | |
| Реакции с металлами и металлорганическими соединениями |
|
| Реакции с активной CH2-группой | 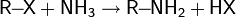 |
| Реакции с участием ацетиленовой группы | 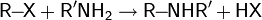 |
Просмотров: 7228
|
|