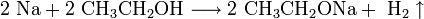Химия - Щелочные металлы - Соединения щелочных металлов
28 февраля 2011Оглавление:
1. Щелочные металлы
2. Химические свойства щелочных металлов
3. Получение щелочных металлов
4. Соединения щелочных металлов
Гидроксиды
Для получения гидроксидов щелочных металлов в основном используют электролитические методы. Наиболее крупнотоннажным является производство гидроксида натрия электролизом концентрированного водного раствора поваренной соли:
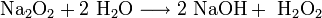
катод: 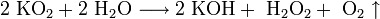
анод: 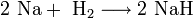
- Прежде щёлочь получали реакцией обмена:
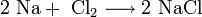
Получаемая таким способом щёлочь была сильно загрязнена содой Na2CO3.
Гидроксиды щелочных металлов — белые гигроскопичные вещества, водные растворы которых являются сильными основаниями. Они участвуют во всех реакциях, характерных для оснований — реагируют с кислотами, кислотными и амфотерными оксидами, амфотерными гидроксидами:
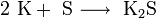
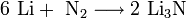
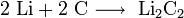
Гидроксиды щелочных металлов при нагревании возгоняются без разложения, за исключением гидроксида лития, который так же, как гидроксиды металлов главной подгруппы II группы, при прокаливании разлагается на оксид и воду:
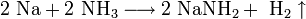
Гидроксид натрия используется для изготовления мыла, синтетических моющих средств, искусственного волокна, органических соединений, например фенола.
Карбонаты
Важным продуктом, содержащим щелочной металл, является сода Na2CO3. Основное количество соды во всём мире производят по методу Сольве, предложенному ещё в начале XX века. Суть метода состоит в следующем: водный раствор NaCl, к которому добавлен аммиак, насыщают углекислым газом при температуре 26 — 30 °C. При этом образуется малорастворимый гидрокарбонат натрия, называемый питьевой содой:
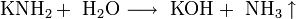
- Аммиак добавляют для нейтрализации кислотной среды, возникающей при пропускании углекислого газа в раствор, и получения гидрокарбонат-иона HCO3, необходимого для осаждения гидрокарбоната натрия. После отделения питьевой соды раствор, содержащий хлорид аммония, нагревают с известью и выделяют аммиак, который возвращают в реакционную зону:
- Таким образом, при аммиачном способе получения соды единственным отходом является хлорид кальция, остающийся в растворе и имеющий ограниченное применение.
При прокаливании гидрокарбоната натрия получается кальцинированная, или стиральная, сода Na2CO3 и диоксид углерода, используемый в процессе получения гидрокарбоната натрия:
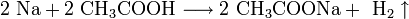
Основной потребитель соды — стекольная промышленность.
В отличие от малорастворимой кислой соли NaHCO3, гидрокарбонат калия KHCO3 хорошо растворим в воде, поэтому карбонат калия, или поташ, K2CO3 получают действием углекислого газа на раствор гидроксида калия:
Поташ используют в производстве стекла и жидкого мыла.
Литий — единственный щелочной металл, для которого не получен гидрокарбонат. Причина этого явления в очень маленьком радиусе иона лития, который не позволяет ему удерживать довольно крупный ион HCO3.
Просмотров: 7194
|
|