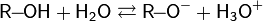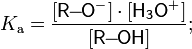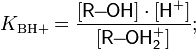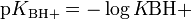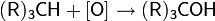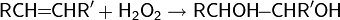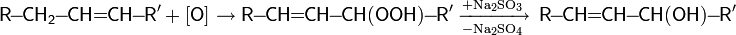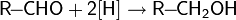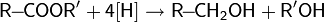Химия - Спирты - Получение спиртов
28 февраля 2011Оглавление:
1. Спирты
2. Классификация спиртов
3. История открытия спиртов
4. Нахождение в природе
5. Физиологическая роль спиртов
6. Физиологическое действие и токсичность спиртов
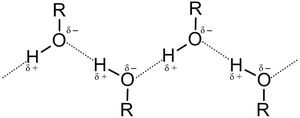
7. Физические свойства и строение спиртов
8. Получение спиртов
9. Химические свойства спиртов
10. Идентификация спиртов
11. Применение спиртов
12. Перечень используемых в статье таблиц
13. Комментарии
Общие химические методы получения спиртов
Спирты могут быть получены из самых разных классов соединений, таких как углеводороды, алкилгалогениды, амины, карбонильные соединения, эпоксиды. Существует множество методов получения спиртов, среди которых выделим наиболее общие:
- основаны на окислении углеводородов, содержащих кратные или активированные C−H связи;
В качестве окислительных агентов для алканов и циклоалканов используются сильные неорганические окислители: озон, перманганат калия, оксид хрома, хромовая кислота, диоксид селена, а также пероксид водорода и некоторые пероксикислоты. Из-за возможности более глубокого окисления, метод имеет значение, как правило, только для получения третичных спиртов:
Окисление алкенов значительно более распространено в лабораторной практике, особенно когда речь идёт о получении диолов. В зависимости от выбора реагента можно осуществить син-гидроксилирование или анти-гидроксилирование и вольфрама, оксид селена и пр.):
Алкены также могут гидроксилироваться в аллильное положение синглетным кислородом с миграцией двойной связи и образованием гидропероксидов, которые затем восстанавливаются до спиртов:
Важным препаративным методом является окисление галогенпроизводных углеводородов надпероксидом калия.
- реакции восстановления — восстановление карбонильных соединений: альдегидов, кетонов, карбоновых кислот и сложных эфиров;
Для восстановления альдегидов или кетонов, обычно, пользуются борогидридом натрия или калия, а также алюмогидридом лития в протонном растворителе:
Восстановление сложных эфиров и карбоновых кислот производится алюмогидридом или борогидридом лития, а также некоторыми другими комплексными гидридами:
- реакции гидратации — кислотно-катализируемое присоединение воды к алкенам;
Реакция имеет промышленное значение, однако в лабораторной практике часто замещается реакцией оксимеркурирования-демеркурирования алкенов или гидроборированием алкенов с их последующим окислением:
- реакции присоединения:
-
- присоединение синтез-газа, формальдегида, оксирана по кратным углеводородным связям;
Простейший пример такой реакции — промышленный синтез метанола:
Среди других вариантов использования:
-
- присоединение нуклеофилов к карбонильным соединениям;
Общая схема реакций подобного типа:
Существует множество реакций присоединения, включая реакции гидратации, этинилирования и прочих, рассмотренных выше. Здесь приведём примеры некоторых важных препаративных методов.
Присоединение аллиборанов с последующим гидролизом:
Реакция Бэйлиса — Хиллмана — Морита:
- реакции замещения — реакции нуклеофильного замещения, при которых имеющиеся функциональные группы замещаются на гидроксильную группу;
На практике для реакций замещения, как правило, используются галогенпроизводные:
- синтезы с использованием металлорганических соединений.
Использование металлорганических соединений для синтеза спиртов — мощный препаративный метод, позволяющий получить спирты из различных производных.
-
- синтез через реактивы Гриньяра:
-
- реакция Циглера:
-
- синтез с использованием органокупратов:
Получение наиболее важных спиртов в промышленности
Промышленные способы получения спиртов можно разделить на две большие группы:
- химические методы производства;
- биохимические методы производства.
Использование этих методов для производства отдельных спиртов представлено в таблицах 9—11.
Таблица 9. Основные современные процессы, используемые для промышленного получения спиртов.
| № | Наименование процесса | Получаемые спирты |
|---|---|---|
| 1. | Гидратация алкенов или эпоксидов | Этанол, пропан-2-ол, бутан-2-ол, 2-метилпропан-2-ол, этиленгликоль |
| 2. | Щелочной гидролиз галогенпроизводных | Аллиловый спирт, глицерин, бензиловый спирт |
| 3. | Щелочной гидролиз сложных эфиров | Глицерин, октан-2-ол, высшие жирные спирты |
| 4. | Реакция гидроформилирования | Метанол, пропан-1-ол, бутан-1-ол, пентан-1-ол, гексанол |
| 5. | Окислительные методы | Пропан-1-ол, бутан-1-ол, высшие жирные спирты |
| 6. | Восстановительные методы | Циклогексанол, ксилит, высшие жирные спирты |
| 7. | Реакция конденсации карбонильных соединений | Бутан-1-ол, 2-этилгексанол, пентаэритрит |
| 8. | Биохимические методы | Этанол, бутан-1-ол, глицерин |
Таблица 10. Основные химические промышленные способы получения экономически наиболее важных спиртов.
| Наименование и формула спирта | Химическая реакция | Краткое описание процесса | Краткие характеристики процесса | Мировое производство | Источники |
|---|---|---|---|---|---|
| Метанол CH3OH |
CO + 2H2 → CH3OH | Каталитический синтез из оксида углерода и водорода | Смешанный медно-цинково-хромовый катализатор, температура 250 °C, давление до 10 МПа | 40,0 млн тонн | |
| Этанол C2H5OH |
CH2=CH2 + H2O → C2H5OH | Сернокислотная или прямая гидратация этилена | Вариант 1: абсорбция этилена концентрированной серной кислотой при температуре 80 °C и давлении 1,5 МПа и последующий гидролиз сульфоэфира.
Вариант 2: прямая гидратация при 300 °C и давлении 7 МПа, катализатор: фосфорная кислота, нанесённая на оксид кремния. |
6 млн тонн | |
| Пропанол-1 C3H7OH |
CH2=CH2 + CO + 2H2 → C3H7OH | Гидроформилирование этилена с последующим гидрированием | Первый этап: температура 80—120 °С, давление 2 МПа, катализатор: карбонил родия. Второй этап: медно-хромовые или никель-хромовые катализаторы. | 0,14 млн тонн | |
| Пропанол-2 CH3CHCH3 |
CH3-CH=CH2 + H2O → CH3CHCH3 | Сернокислотная или прямая гидратация пропилена | Вариант 1: абсорбция пропилена серной кислотой при комнатной температуре 80 °C и давлении 2—3 МПа и последующий гидролиз сульфоэфира.
Вариант 2: прямая гидратация на фосфорнокислом или вольфрамовом катализаторе. |
1,8 млн тонн | |
| Высшие жирные спирты | 1. RCOOCH3 + 2H2 → RCH2OH + CH3OH 2. RCH=CH2 + CO + 2H2 → RCH2CH2CH2OH |
1. Гидрирование метиловых эфиров жирных кислот, получаемых переэтерификацией жиров и масел. 2. Гидроформилирование алкенов. |
1. Гидрирование при высокой температуре и давление на смешанных меднохромовых или других катализаторах. 2. Высокотемпературный газофазный процесс в присутствии модифицированного карбонила кобальта. 3. Многостадийный синтез в относительно мягких условиях. |
2,15 млн тонн | . |
| Этиленгликоль HOCH2CH2OH |
O + H2O → HOCH2CH2OH | Некаталитическая гидратация окиси этилена | Температура 200 °C и давление 1,5—2 МПа | 18,0 млн тонн | |
| Глицерин HOCH2CHCH2OH |
CH2CHCH2OCOR + 3NaOH → HOCH2CHCH2OH + 3RCOONa | Щелочной гидролиз растительных жиров и масел | Температура 150—180 °С, давление 1 МПа, катализаторы. | 1,5 млн тонн |
Таблица 11. Получение спиртов биохимическими методами.
| Наименование спирта | Исходное сырьё | Краткое описание процесса |
|---|---|---|
| Этанол | целлюлозное сырьё: древесина, солома, багасса, отходы деревообрабатывающего и целлюлозного производства | Кислотный или энзимный гидролиз растительного сырья с последующей анаэробной спиртовой ферментацией образующихся моно- и олигосахаридов дрожжевыми грибами или некоторыми видами бактерий. |
| крахмал- и сахарсодержащее сырьё: сахарная свекла, картофель, маниок, злаковые культуры | ||
| Бутанол | крахмалсодержащее сырьё: сахарная свекла, картофель, маниок, злаковые культуры | Аналогично производству биоэтанола, но с применением бутанольной ферментации бактериями Clostridium. |
| Глицерин | сыворотка, сахарная меласса, пшеничный гидролизат | Ферментация сахаросодержащего сырья дрожжевыми грибами в присутствии сульфита натрия. |
Просмотров: 148044
|
|