Химия - Сульфамидная кислота
01 марта 2011Оглавление:
1. Сульфамидная кислота
2. Применение
Свойства
Внешний вид предстваляет собой бесцветные ромбические кристаллы. Кристаллические модификации, цвет растворов и паров: Ромбическая сингония, a = 0,8036 нм, b = 0,8025 нм, c = 0,9236 нм, z = 8. В кристаллическом состоянии существует в виде цвиттер-иона.
Молекулярная масса: 97,098. Температура плавления: 205. Температура разложения: 260. Растворимость: ацетон: 0,04, вода: 12,8, вода: 17,57, вода: 22,77, вода: 27,06, вода: 32,01, диэтиловый эфир: 0,01, метанол: 0,4, формамид: 0,18. Плотность: 2,126
Химические свойства
В кристаллическом состоянии сульфаминовая кислота образует цвиттер-ион 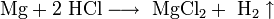 . При нагревании до 260 °C разлагается на SO2, SO3, N2 и Н2О. При комнатной температуре сульфаминовая кислота практически не подвергается гидролизу, при повышенных температурах гидролизуется до2SO4. С металлами, их оксидами, гидроксидами и карбонатами сульфаминовая кислота образует соли NH2SO3M, с тионилхлоридом — сульфамоилхлорид NH2SO2Cl. При взаимодействии с HNO2 подвергается окислительному дезаминированию — NH2SO3H + HNO2
. При нагревании до 260 °C разлагается на SO2, SO3, N2 и Н2О. При комнатной температуре сульфаминовая кислота практически не подвергается гидролизу, при повышенных температурах гидролизуется до2SO4. С металлами, их оксидами, гидроксидами и карбонатами сульфаминовая кислота образует соли NH2SO3M, с тионилхлоридом — сульфамоилхлорид NH2SO2Cl. При взаимодействии с HNO2 подвергается окислительному дезаминированию — NH2SO3H + HNO2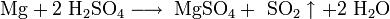 Н2О+N2+H2SO4. Последнюю реакцию используют для количественного определения сульфаминовой кислоты и для разложения избытка HNO2 в производстве азокрасителей.
Н2О+N2+H2SO4. Последнюю реакцию используют для количественного определения сульфаминовой кислоты и для разложения избытка HNO2 в производстве азокрасителей.
Хлор, бром, хлораты и КМnО4 окисляют сульфаминовую кислоту до H2SO4 и N2. Реакция с НClО или NaClO приводит к N-хлор- или N,N-дихлорпроизводным. Реакция с Na в жидком NH3 к NaSO3NHNa, а с Na2SO4 к аддукту 6HSO3NH2·5Na2SO4·15Н2О.
Сульфаминовая кислота реагирует с фенолами, первичными и вторичными спиртами, например: С6Н5ОН + NH2SO3H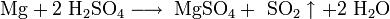 C6H5OSO3NH4
C6H5OSO3NH4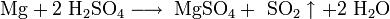 HOC6H4SO2ONH4. Первичные, вторичные и третичные амины образуют с сульфаминовой кислотой аминосульфаматы RNH2·HOSO2NH2, амиды карбоновых к-т-N-ацилсульфаматы аммония, например:
HOC6H4SO2ONH4. Первичные, вторичные и третичные амины образуют с сульфаминовой кислотой аминосульфаматы RNH2·HOSO2NH2, амиды карбоновых к-т-N-ацилсульфаматы аммония, например: 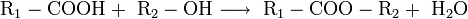 .
.
Для идентификации сульфаминовой кислоты используют реакцию с HNO2, сплавление с бензоином и другими.
Просмотров: 3628
|
|