Химия - Сульфат железа(III)
15 июля 2011Оглавление:
1. Сульфат железа(III)
2. Нахождение в природе
3. Получение
4. Химические свойства
Сульфат железа Ferrisulfat) — неорганическое химическое соединение, соль, химическая формула — 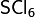 .
.
Физические свойства
Безводный сульфат железа — светло-желтые, парамагнитные, очень гигроскопичные кристаллы моноклинной сингонии, пространственная группа P21/m, параметры элементарной ячейки a = 0,8296 нм, b = 0,8515 нм,c = 1,160 нм, β = 90,5°, Z = 4. Есть данные, что безводный сульфат железа образовывает орторомбическую и гексагональную модификации. Растворим в воде и ацетоне, не растворяется в этаноле.
Из воды кристаллизуется в виде кристаллогидратов Fe23·n H2O, где n = 12, 10, 9, 7, 6, 3. Наиболее изученный кристаллогидрат — нонагидрат сульфата железа Fe23·9H2O — жёлтые гексагональные кристаллы, параметры элементарной ячейки a = 1,085 нм, c = 1,703 нм, Z = 4. Хорошо растворяется в воде и этаноле, не растворяется в ацетоне. В водных растворах сульфат железа из-за гидролиза приобретает красно-коричневый цвет.
При нагревании нонагидрат превращается при 98 °C в тетрагидрат, при 125 °C — в моногидрат и при 175 °C — в безводный Fe23, который выше 600 °C разлагается на Fe2O3 и SO3.
Просмотров: 9030
|
|