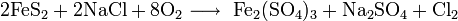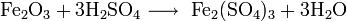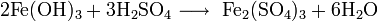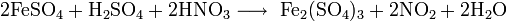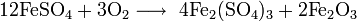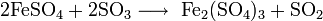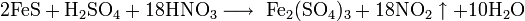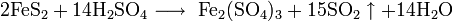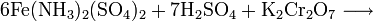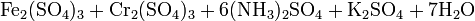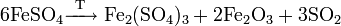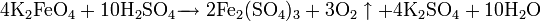Химия - Сульфат железа(III) - Химические свойства
15 июля 2011Оглавление:
1. Сульфат железа(III)
2. Нахождение в природе
3. Получение
4. Химические свойства
Сульфат железа в водных растворах подвергается сильному гидролизу по катиону, при этом раствор окрашивается в красновато-коричневый цвет:
Горячая вода или пар разлагают сульфат железа:
Безводный сульфат железа при нагревании разлагается:
Растворы щелочей разлагают сульфат железа, продукты реакции зависят от концентрации щёлочи:
Если с щёлочью взаимодействует эквимолярный раствор сульфатов железа и железа, то в результате получится сложный оксид железа:
Активные металлы восстанавливают сульфат железа:
Некоторые сульфиды металлов в водном растворе восстанавливают сульфат железа:
С растворимыми солями ортофосфорной кислоты образует нерастворимый фосфат железа:
Использование
- Как реактив при гидрометаллургической переработке медных руд.
- Как коагулянт при очистке сточных вод, коммунальных и промышленных стоков.
- Как протрава при в окраске тканей.
- При дублении кожи.
- Для декапирования нержавеющих аустенитных сталей, сплавов золота с алюминием.
- Как флотационый регулятор для уменьшения плавучести руд.
- В медицине используется в качестве вяжущего и кровоостанавливающего средства.
- В химическое промышленности как окислитель и катализатор.
Просмотров: 8922
|
|