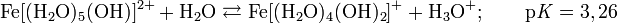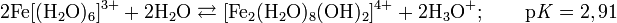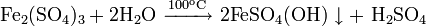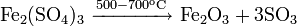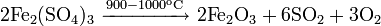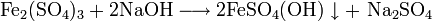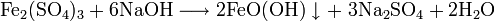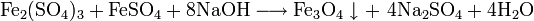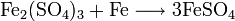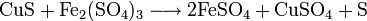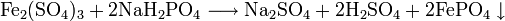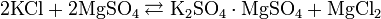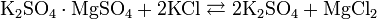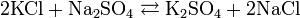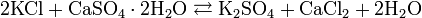Химия - Сульфат калия
28 февраля 2011Оглавление:
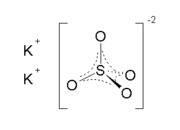
1. Сульфат калия
2. Химические свойства
3. Сведения о безопасности
История
Сульфат калия был известен с начала 14-го века, изучен Глаубером, Бойлом и Тахеусом. В 17 веке он был назван arcanuni или sal duplicatum — эти названия были для кислот и щелочных солей.
Нахождение в природе
В природе находится на месторождениях калийных солей. Присутствует в водах солёных озёр.
Физические свойства
Бесцветные кристаллы, ромбическая сингония. При температуре выше 584 °C переходит в гексагональную модификацию.
Хорошо растворим в воде, не подвергается гидролизу. Нерастворим в концентрированных растворах щелочей или в чистом этаноле.
Получение
Минеральные формы чистого сульфата калия относительно редки. Минерал арканит состоит из чистого K2SO4, представляет собой белые или прозрачные кристаллы, встречается в Калифорнии.
Есть много минералов, содержащих соли калия:
- Каинит — MgSO4·KCl·H2O
- Глазерит — 2K2SO4·Na2SO4
- Шенит — K2SO4·MgSO4·6H2O
- Леонит — K2SO4·MgSO4·4H2O
- Лангбейнит — K2SO4·2MgSO4
- Полигалит — K2SO4·MgSO4·2CaSO4·2H2O
- Сингенит — K2SO4·CaSO4·H2O
Промышленные методы получения основаны на обменных реакциях KCl с различными сульфатами и в результате сульфат калия, как правило, сильно загрязнён побочными продуктами:
Наиболее чистый продукт получают обрабатывая твёрдый хлорид калия концентрированной серной кислотой:
Прокаливанием с углём минерала лангбейнита:
В лабораторной практике применяют следующие методы:
- из оксида калия:
- вытеснением из слабых или неустойчивых кислот:
- из щёлочи и разбавленной кислоты:
- из гидросульфата калия:
- окислением сульфида калия:
- из надперекиси калия:
Сульфат калия получается при нагреве сульфита калия до температуры в 600 °C:
Окисление серы бихроматом калия:
Просмотров: 5029
|
|