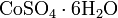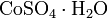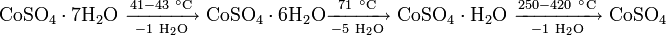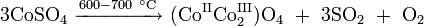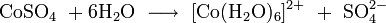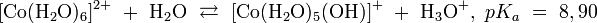Химия - Сульфат кобальта(II) - Химические свойства
15 июля 2011Оглавление:
1. Сульфат кобальта(II)
2. Физические свойства
3. Химические свойства
4. Получение
Разложение
Кристаллогидраты сульфата кобальта при нагревании разлагаются, теряя кристаллизационную воду:
При дальнейшем нагревании безводный сульфат кобальта разлагается до двойного оксида с выделением диоксида серы и кислорода:
Гидролиз
При растворении в воде сульфат кобальта диссоциирует, при этом происходит гидратация катиона:
Катион гексааквакобальта обратимо гидролизуется, давая кислую среду:
Обменные реакции в растворе
- В водных растворах сульфат кобальта вступает в реакции с щелочами:
- с концентрированной щёлочью образуется фиолетово-синий осадок гидроксида кобальта:
- с разбавленной щёлочью образуются осадки основных сульфатов кобальта различного состава, в частности:
 голубого цвета;
голубого цвета; синего цвета;
синего цвета; фиолетового цвета.
фиолетового цвета.
- При взаимодействии концентрированного раствора сульфата кобальта с насыщенными растворами сульфатов ряда щелочных металлов или аммония образуется осадок двойных солей:
- При взаимодействии раствора сульфата кобальта с растворами ортофосфатов или арсенатов щелочных металлов выпадает осадок соответствующих солей кобальта:
- Кроме того, сульфат кобальта вступает во все обменные реакции, характерные для растворимых солей кобальта и растворимых сульфатов, например:
- образует осадок сульфида кобальта при взаимодействии с гидросульфидом аммония
- образует осадок сульфата бария при взаимодействии с нитратом бария
Образование комплексных соединений
- При взаимодействии сульфата кобальта с концентрированным гидратом аммиака образуется жёлтый осадок сульфата гексаамминкобальта:
- В сернокислых растворах сульфат кобальта образует комплексные анионы, в частности анион дисульфатокобальтата:
Образование соединений кобальта
Сульфат кобальта окисляется до соединений кобальта при действии сильных окислителей.
- При озонировании раствора сульфата кобальта в серной кислоте образуется раствор сульфата кобальта:
- При фторировании раствора сульфата кобальта в 4N серной кислоте при 0 °C выпадает осадок 18-гидрата сульфата кобальта:
Электролиз
При электролизе водного раствора сульфата кобальта на катоде выделяется металлический кобальт, на аноде выделяется кислород:
Данный процесс используется для гальванического покрытия других металлов кобальтом.
Просмотров: 6157
|
|