Химия - Сульфид бария
28 февраля 2011Физические свойства
BaS представляет собой бесцветные кубические кристаллы хорошо растворимые в воде, практически нерастворимые в спирте. Из раствора кристаллизуется в виде гексагидрата BaS•6H2O.
Получение
- В промышленности: прокаливание сульфата бария с углем или коксом:
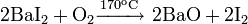
- В лаборатории: пропускание сероводорода через раствор гидроксида бария при охлаждении:

Химические свойства
1. Легко разлагается кислотами с выделением сероводорода:
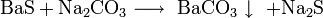
2. Гидролизуется водой до гидросульфида:
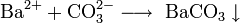
3. Водные растворы BaS медленно окисляются кислородом воздуха с выделением серы:
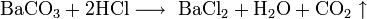
4. При прокаливании на воздухе образуется сульфат бария:
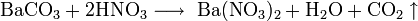
Применение
- Промежуточный продукт при получении бария и его соединений.
- Для удаления волосяного покрова со шкур в кожевенной промышленности.
Токсичность
Сульфид бария является ядовитым веществом как вследствие токсичности сероводорода, образующегося в результате его гидролиза, так и из-за ионов бария. Следует различать сульфид и сульфат бария, используемый в медицине как рентгеноконтрастный препарат. Случайная замена этих веществ может привести к летальному исходу.
Просмотров: 3179
|
|