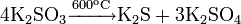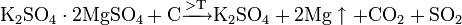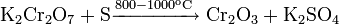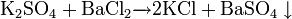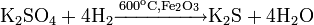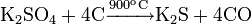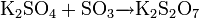Химия - Сульфид калия
28 февраля 2011Оглавление:
1. Сульфид калия
2. Применение
бинарное неорганическое химическое соединение калия с серой. Представляет собой соединение с формулой K2S.
Физические свойства
Сульфид калия K2S — бесцветные кубические кристаллы. Хорошо растворимы в воде. Растворим в спирте и глицерине. Гигроскопичен, образует ди- и пентагидраты.
Получение
Прямой синтез из элементов:
Восстановление сульфата калия водородом:
или углеродом:
Сульфит калия при нагревании диспропорционирует:
Химические свойства
На воздухе медленно окисляется:
в зависимости от условий проведения этой реакции образуются побочные продукты: коллоидная сера, полисульфиды калия.
Сульфид калия при поджигании сгорает:
Так как сероводород является слабой кислотой, то сульфид калия разлагается кислотами:
Концентрированные кислоты могут окислять выделяемый сероводород:
При кипячении раствора сульфида калия с серой или сплавления его с серой образуются полисульфиды:
для калия выделены полисульфиды вплоть до n = 6.
При пропускании через раствор сульфида калия избытка сероводорода образуются гидросульфид калия:
Реагирует, образовывая соединения с сульфидами Ag, Sn и другими.
Просмотров: 4564
|
|