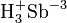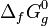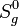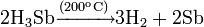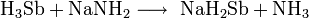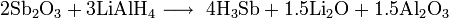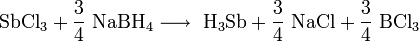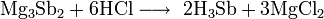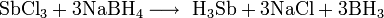Химия - Сульфид лития
28 февраля 2011Оглавление:
1. Сульфид лития
2. Получение
3. Полисульфиды лития
4. Опасность для здоровья
Сульфид лития, сернистый литий — Li2S, неорганическое бинарное соединение, литиевая соль сероводородной кислоты.
Физические свойства
Сульфид лития представляет собой светло-жёлтое или бесцветное кристаллическое вещество, характеризующееся гранецентрированной кубической решёткой типа флюорита, хорошо растворимое в воде, растворимое в спирте. Не образует кристаллогидратов.
Основные термодинамические характеристики:
- стандартная энтальпия образования, ΔH298 = −447 кДж/моль;
- стандартная энтропия образования, S298 = 63 Дж/;
- стандартная энергия Гиббса образования, ΔG298 = −439 кДж/моль.
Химические свойства
- Сульфид лития, растворяясь в воде, подвергается гидролизу:
- Пропуская через водный раствор сероводород, реакцию гидролиза можно сместить вправо:
- Образующийся сильно гигроскопичный гидросульфид лития можно выделить в чистом виде.
- Водный раствор под действием кислорода воздуха на холоду постепенно окисляется, образуя осадок элементарной серы:
- Во влажном воздухе вещество постепенно окисляется до тиосульфата:
- При действии окислителей при нагревании свыше 300 °C сульфид лития окисляется до сульфата:
- При нагревании реагирует с хлором и бромом:
- Иначе протекает реакция с йодом при температуре около 200 °C:
- С водородом не реагирует даже при высокой температуре.
- Вступает в реакции с разбавленными кислотами с выделением сероводорода:
- Являясь сильным восстановителем, с концентрированными серной и азотной кислотами, сульфид лития вступает в окислительно-восстановительные реакции:
Просмотров: 5661
|
|