Химия - Сульфит натрия
28 февраля 2011Свойства
Натрия сульфит — сильный восстановитель. При обычной температуре из водных растворов кристаллизуется Na2SO3×7H2O. В водных растворах легко окисляется кислородом воздуха. В водных растворах Na2SO3 присоединяет при нагревании серу с образованием тиосульфата натрия.
Получение
Натрия сульфит получают:
- взаимодействием растворов Na2CO3 с SO2;
- нейтрализацией раствора NaHSO3 раствором соды при 38—40 °C с последующим охлаждением и кристаллизацией гептагидрата.
Безводную соль:
- выделяют кристаллизацией при 95—100 °C или обезвоживанием гептагидрата;
- получают реакцией NaHSO3 с Са2;
- получают как побочный продукт при производстве фенола из бензолсульфокислоты.
После проведения следующей реакции получим сульфит натрия: 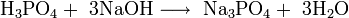
Применение
Натрия сульфит применяют как компонент фиксажей и проявителей в фотографии, для удаления следов хлора после отбеливания тканей, для удаления S из вискозного волокна после формования, как флотореагент для руд цветных металлов, в производстве пестицидов, для обезвреживания сточных вод, содержащих Сr, входит в состав фотографических проявителей. Временно допустимая концентрация в воздухе 0,1 мг/м³.
Просмотров: 2425
|
|