Химия - Теория отталкивания электронных пар
28 февраля 2011Самая подробная информация Пульт для весов купить на нашем сайте.
Оглавление:
1. Теория отталкивания электронных пар
2. Развитие теории ОЭПВО и примеры
3. Недостатки теории ОЭПВО и отклонения от ее предсказаний
4. Основной источник
один из подходов в химии, необходимый для объяснения и предсказания геометрии молекул. Согласно этой теории молекула всегда будет принимать форму, при которой отталкивание внешних электронных пар минимально.
История
В 1940 г. Н. Сиджвик и Г. Пауэлл предложили модель отталкивания электронных пар, которая впоследствии была развита Р. Гиллеспи и Р. Найхолмом. Основные идеи этого подхода, приложимого только к соединениям непереходных элементов, сводятся к следующему:
- Конфигурация связей многовалентного атома обусловливается исключительно числом связывающих и несвязывающих электронных пар в валентной оболочке центрального атома.
- Ориентация облаков электронных пар валентных орбиталей определяется максимальным взаимным отталкиванием заполняющих их электронов.
Описание
Если бы природа сил взаимного отталкивания электронных пар имела чисто электростатический характер, эти силы определялись бы соотношением, где n = 2. Однако кроме электростатического взаимодействия электронные пары на разных локализованных молекулярных орбиталях испытывают отталкивание еще в силу действия принципа Паули, поэтому в выражении для сил 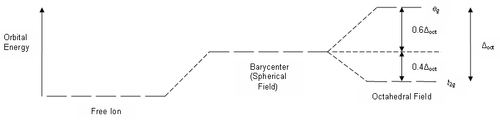 , где r — расстояние между «центрами тяжести» облаков электронных пар ЛМО,
, где r — расстояние между «центрами тяжести» облаков электронных пар ЛМО,  . Задача поиска расположения центров облаков электронных пар, расталкивающихся в соответствии с при равных для всех пар величинах r, эквивалентна задаче размещения нескольких частиц на поверхности сферы при их максимальном удалении друг от друга. Эта задача решается строго для числа частиц от 2 до 12 и дает следующий результат:
. Задача поиска расположения центров облаков электронных пар, расталкивающихся в соответствии с при равных для всех пар величинах r, эквивалентна задаче размещения нескольких частиц на поверхности сферы при их максимальном удалении друг от друга. Эта задача решается строго для числа частиц от 2 до 12 и дает следующий результат:
Таблица 1. Конфигурация связей центрального атома А в зависимости от числа электронных пар q на его валентных орбиталях.
| q | Конфигурация |
|---|---|
| 2 | Линейная |
| 3 | Равносторонний треугольник |
| 4 | Тетраэдр |
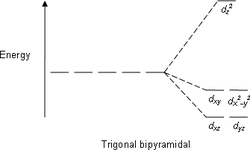
| 5 | Тригональная бипирамида |
| 6 | Октаэдр |
| 7 | Октаэдр с дополнительной вершиной |
| 8 | Квадратная антипризма |
| 9 | Треугольная призма с тремя дополнительными вершинами |
| 10 | Квадратная антипризма с двумя дополнительными вершинами |
| 11 | Икосаэдр без одной вершины |
| 12 | Икосаэдр |
В таблице 1 в число q входят электронные пары как на связывающих ЛМО, так и на несвязывающих, то есть неподеденные электронные пары. Гиллеспи ввел для связывающих электронных пар обозначение X, а для несвязывающих — Е. С учетом этих обозначений можно следующим образом представить геометрическую конфигурацию молекул типа AXmEn. Как видно из данных таблицы 2, в рамках теории ОЭПВО для определения топологии связей центрального атома в молекулах, образованных непереходными элементами, необходимо только сосчитать число электронных пар на связывающих и несвязывающих орбиталях и разместить их на осях соответствующего многогранника.
Таблица 2-3. Геометрия структуры молекул типа AXmEn без кратных связей.
| Общее число электронных пар. |
Геометрия 0 свободных пар |
1 свободная пара | 2 свободные пары | 3 свободные пары |
|---|---|---|---|---|
| 2 | ||||
| 3 |  |
 |
||
| 4 | 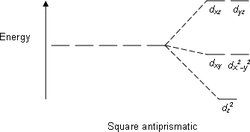 |
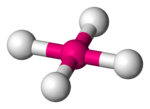 |
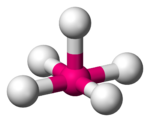 |
|
| 5 | 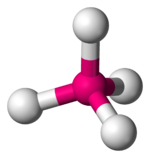 |
 |
 |
 |
| 6 | 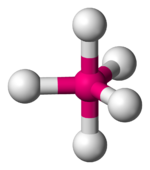 |
 |
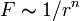 |
|
| 7 |  |
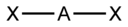 |
| Тип молекулы | Конфигурация | Расположение электронных пар | Геометрия | Примеры |
|---|---|---|---|---|
| AX1En | Двухатомная | HF, O2 | ||
| AX2E0 | Линейная | BeCl2, HgCl2, CO2 | ||
| AX2E1 | Искаженная | 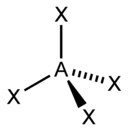 |
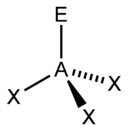 |
NO2, SO2, O3 |
| AX2E2 | Искаженная | 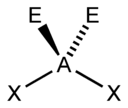 |
 |
H2O, OF2 |
| AX2E3 | Линейная | 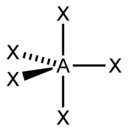 |
XeF2, I3 | |
| AX3E0 | Равносторонний треугольник | 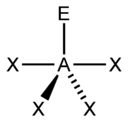 |
 |
BF3, CO3, NO3, SO3 |
| AX3E1 | Тригональная пирамида | 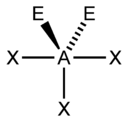 |
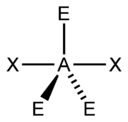 |
NH3, PCl3 |
| AX3E2 | Т-образная | 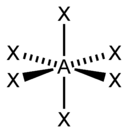 |
 |
ClF3, BrF3 |
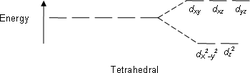
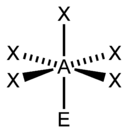
| AX4E0 | Тетраэдр | 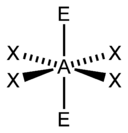 |
 |
CH4, PO4, SO4, ClO4 |
| AX4E1 | Дисфеноид | 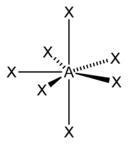 |
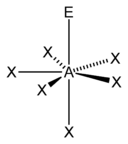 |
SF4 |
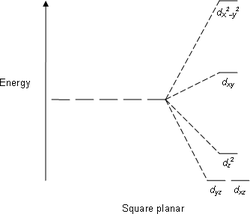
| AX4E2 | Плоскоквадратная геометрия | 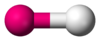 |
 |
XeF4 |
| AX5E0 | Тригональная бипирамида |  |
 |
PCl5 |
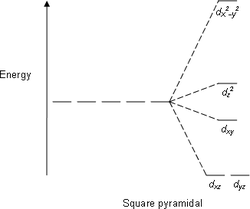
| AX5E1 | Квадратная пирамида |  |
 |
ClF5, BrF5 |
| AX6E0 | Октаэдр | 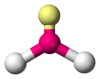 |
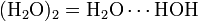 |
SF6 |
| AX6E1 | Пентагональная пирамида | 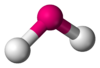 |
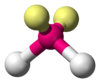 |
XeF6 |
| AX7E0 | Пентагональная бипирамида | 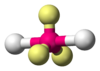 |
 |
IF7 |
Просмотров: 10027
|
|