Химия - Тиосульфаты
28 февраля 2011Оглавление:
1. Тиосульфаты
2. Органические тиосульфаты
3. Применение
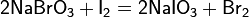
соли и сложные эфиры тиосерной кислоты, H2S2O3. Тиосульфаты неустойчивы, поэтому в природе не встречаются. Наиболее широкое применение имеют тиосульфаты натрия и аммония, а также соли Бунте — органические тиосульфаты с атомом водорода, замещённым углеводородным радикалом.
История открытия и исследования
Органические тиосульфаты были исследованы немецким химиком Гансом Бунте в 1872 году в его докторской диссертации.
Неорганические тиосульфаты
Строение
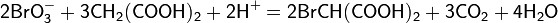
Тиосульфат-ион по строению близок к сульфат-иону. В тетраэдре связь S-S длиннее, чем связи S-O.
Физические свойства
Растворимость в воде:
- K2S2O3 200,1, 233,4
- 2S2O3 150
- MgS2O3 49,8
- CaS2O3 42,9
- SrS2O3 15,3
- BaS2O3 0,2
- Tl2S2O3 0,18
- PbS2O3 0,02
Образуют кристаллогидраты, при нагревании которых происходит плавление, представляющее собой растворение тиосульфатов в кристаллизационной воде.
- К2S2O3·5Н2О — температура плавления 35,0 °C
- К2S2O3·3Н2О — температура плавления 56,1 °C
- K2S2O3·H2О — температура плавления 78,3 °C, плотность 2,590 г/см3
- MgS2O3·6H2O — температура плавления выше 82 °C, плотность 1,818 г/см3
- CaS2O3·6H2O — температура плавления выше 40 °C, плотность 1,872 г/см3
Получение
Тиосульфаты получаются при взаимодействии растворов сульфитов с сероводородом:
2HSO3 + 2H2S → S2O3 + 3H2O
При кипячении растворов сульфитов с серой:
Na2SO3 + S → Na2S2O3
При окислении полисульфидов кислородом воздуха:
2Na2S2 + 3O2 → 2Na2S2O3
2Na2S5 + 3O2 → 2Na2S2O3 + 6S
Химические свойства
Тиосерная кислота в присутствии воды разлагается:
H2S2O3 → S + SO2 + H2O,
поэтому её выделение из водного раствора невозможно. Свободная тиосерная кислота может быть получена при взаимодействии хлорсульфоновой кислоты с сероводородом при низкой температуре:
HSO3Cl + H2S → H2S2O3 + HCl.
Выше 0 °C свободная тиосерная кислота необратимо разлагается:
H2S2O3 → SO2 + S + H2O.
Благодаря наличию серы в степени окисления −2 тиосульфат-ион обладает восстановительными свойствами. Слабыми окислителями тиосульфаты окисляются до тетратионатов:
2S2O3 + 2Fe → S4O6 + 2Fe
2S2O3 + I2 → S4O6 + 2I
Более сильные окислители окисляют тиосульфаты до сульфатов:
S2O3 + 4Cl2 + 5H2O → SO4 + 8Cl + 10H
Сильные восстановители восстанавливают тиосульфат-ион до сульфида, например:
3S2O3 + 8Al + 14OH + 9H2O → 6S + 8
Тиосульфат-ион также является сильным комплексообразователем:
Ag + 2S2O3 →
Так как тиосульфат-ион координируется с металлами через атом серы в степени окисления −2, в кислой среде тиосульфатные комплексы легко переходят в сульфиды:
2 + 2H → Ag2S + 2SO2 + H2O
Из-за наличия атомов серы в разных степенях окисления в кислой среде тиосульфаты склонны к реакциям конпропорционирования:
S2O3 + 2H → S + SO2 + H2O
Просмотров: 6331
|
|