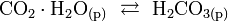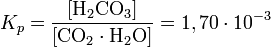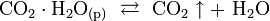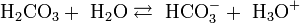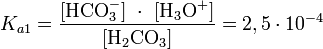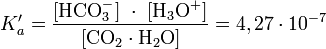Химия - Угольная кислота
01 марта 2011Самая свежая информация выкуп авто в залоге здесь.
Оглавление:
1. Угольная кислота
2. Получение
слабая двухосновная кислота с химической формулой H2CO3. В чистом виде неустойчива. Образуется в малых количествах при растворении углекислого газа в воде, в том числе и углекислого газа из воздуха. Образует ряд устойчивых неорганических и органических производных: соли, сложные эфиры, амиды и др.
Физические свойства
Молекула угольной кислоты имеет плоское строение. Центральный углеродный атом имеет sp²-гибридизацию. В гидрокарбонат- и карбонат-анионах происходит делокализация π-связи. Длина связи C—O в карбонат-ионе составляет 129 пм.
Химические свойства
Равновесие в водных растворах и кислотность
Угольная кислота существует в водных растворах в состоянии равновесия с гидратом диоксида углерода:
 , константа равновесия при 25 °C
, константа равновесия при 25 °C 
Скорость прямой реакции 0,039 с, обратной — 23 с.
В свою очередь растворённый гидрат диоксида углерода находится в равновесии с газообразным диоксидом углерода:
Данное равновесие при повышении температуры сдвигается вправо, а при повышении давления — влево.
Угольная кислота подвергается обратимому гидролизу, создавая при этом кислую среду:
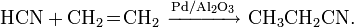 , константа кислотности при 25 °C
, константа кислотности при 25 °C 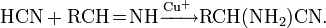
Однако, для практических расчётов чаще используют кажущуюся константу кислотности, учитывающую равновесие угольной кислоты с гидратом диоксида углерода:
Гидрокарбонат-ион подвергается дальнейшему гидролизу по реакции
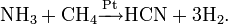 , константа кислотности при 25 °C
, константа кислотности при 25 °C 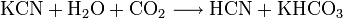
Таким образом, в растворах, содержащих угольную кислоту, создается сложная равновесная система, которую можно изобразить в общем виде следующим образом:
Значение pH в такой системе, соответствующей насыщенному раствору диоксида углерода в воде при 25 °C и давлении 760 мм рт. ст., можно рассчитать по формуле:
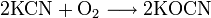 , где L = 0,034 моль/л — растворимость CO2 в воде при указанных условиях.
, где L = 0,034 моль/л — растворимость CO2 в воде при указанных условиях.
Разложение
При повышении температуры раствора и/или понижении парциального давления диоксида углерода равновесие в системе  смещается влево, что приводит к разложению части угольной кислоты на воду и диоксид углерода. При кипении раствора угольная кислота разлагается полностью:
смещается влево, что приводит к разложению части угольной кислоты на воду и диоксид углерода. При кипении раствора угольная кислота разлагается полностью:
Взаимодействие с основаниями и солями
Угольная кислота вступает в реакции нейтрализации с растворами оснований, образуя средние и кислые соли — карбонаты и гидрокарбонаты соответственно:
При взаимодействии угольной кислоты с карбонатами образуются гидрокарбонаты:
Просмотров: 10250
|
|