Химия - Уравнение Аррениуса
01 марта 2011Уравнение Аррениуса устанавливает зависимость константы скорости химической реакции 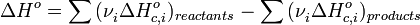 от температуры
от температуры  .
.
Согласно простой модели столкновений химическая реакция между двумя исходными веществами может происходить только в результате столкновения молекул этих веществ. Но не каждое столкновение ведёт к химической реакции. Необходимо преодолеть определённый энергетический барьер, чтобы молекулы начали друг с другом реагировать. То есть молекулы должны обладать некой минимальной энергией, чтобы этот барьер преодолеть. Из распределения Больцмана для кинетической энергии молекул известно, что число молекул, обладающих энергией  , пропорционально
, пропорционально  . В результате скорость химической реакции представляется уравнением, которое было получено шведским химиком Сванте Аррениусом из термодинамических соображений:
. В результате скорость химической реакции представляется уравнением, которое было получено шведским химиком Сванте Аррениусом из термодинамических соображений:
Здесь  характеризует частоту столкновений реагирующих молекул,
характеризует частоту столкновений реагирующих молекул,  — универсальная газовая постоянная.
— универсальная газовая постоянная.
В рамках теории активных соударений  зависит от температуры, но эта зависимость достаточно медленная:
зависит от температуры, но эта зависимость достаточно медленная:
Оценки этого параметра показывают, что изменение температуры в диапазоне от 200 °C до 300 °C приводит к изменению частоты столкновений A на 10 %.
В рамках теории активированного комплекса получаются другие зависимости  от температуры, но во всех случаях более слабые, чем экспонента.
от температуры, но во всех случаях более слабые, чем экспонента.
Уравнение Аррениуса стало одним из основных уравнений химической кинетики, а энергия активации — важной количественной характеристикой реакционной способности веществ.
Просмотров: 2880
|
|