Химия - Уравнение Бренстеда
01 марта 2011уравнение, количественно описывающее зависимость скорости катализируемых кислотами или основаниями реакций от природы кислоты. Впервые предложено в 1924 г. Бренстедом и Педерсеном.
Для кислотного катализа уравнение выражается в виде 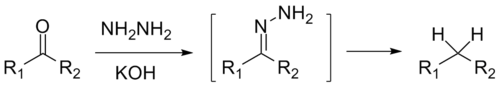
где ka — каталитическая константа скорости реакции;
Ka — константа кислотности кислоты, выступающей в качестве катализатора;
k0 — константа скорости некатализируемой реакции;
α — константа, характеризующая реакционную серию и отражающая чувствительность скорости реакции к смене катализатора.
В общем виде уравнение записывается в виде 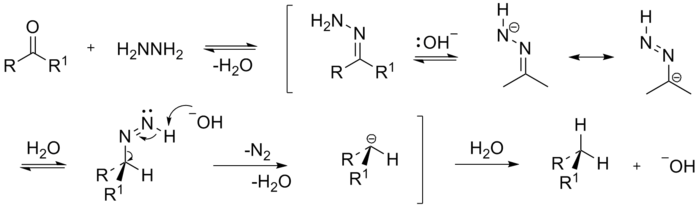 как линейная зависимость константы скорости реакции от логарифма константы ионизации Ka кислот одной серии.
как линейная зависимость константы скорости реакции от логарифма константы ионизации Ka кислот одной серии.
Уравнение Бренстеда — один из примеров выполнения общего соотношения линейности свободных энергий, согласно которому изменения в свободных энергиях реакций ΔG и в свободных энергиях активаций ΔG, вызываемые в различных реакциях одинаковыми вариациями структуры реагирующих соединений или среды, связаны линейными зависимостями. В данном уравнении свободная энергия Гиббса кислотной диссоциации пропорциональна энергии активации каталитической стадии реакции
Для основного катализа уравнение выражается в аналогичном виде:
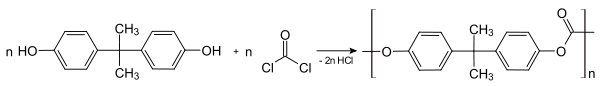
Параметры уравнения определяют экспериментально. Значения α и β лежат в диапазоне 0÷1. Уравнение Бренстеда даёт информацию о механизме реакции. Для реакций с небольшими значениями α или β переходное состояние характеризуется малым переносом протона. В случае высоких значений реакция сопровождается полным переносом протона.
Просмотров: 2014
|
|