Химия - Уравнение Лейдлера Эйринга
01 марта 2011Оглавление:
1. Уравнение Лейдлера Эйринга
2. Пример использования
Уравнение Лейдлера-Эйринга — уравнение, описывающее зависимость константы скорости химической реакции от полярности растворителя. Выражается в виде
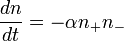
где
- k — константа скорости реакции в исследуемом растворителе
- ε — диэлектрическая проницаемость растворителя
- U — величина, отражающая зависимость константы скорости реакции от смены растворителя.
- величина/ определяет полярность растворителя.
С увеличением скорости реакции при переходе от менее полярных растворителей к более полярным величина U является положительной. Это указывает на то, что переходный комплекс реакции является более полярным и легче сольватируется, чем исходные реагенты, что ускоряет протекание реакции. Отрицательная величина U свидетельствует о менее полярном характере переходного комплекса.
Уравнение Лейдлера-Эйринга применимо только в тех случаях, когда в процессе не проявляются дисперсионные силы, а специфическая сольватация отсутствует. В противном случае используют другие корреляционные уравнения, например, уравнение Димрота-Рейнхардта.
Просмотров: 2337
|
|